*仅供医学专业人士阅读参考


大脑的复杂之处在于众多神经元之间的协同作用,若能在同一时间显示不同神经元群体的电活动,那么将大大加深我们对于大脑功能的理解。
基因编码的电压指示蛋白(GEVI)是一类在细胞膜电位变化后产生可检测信号的蛋白,时间分辨率可达亚毫秒级,非常适合用于监测活体动物的神经元电活动[1]。然而,现有的GEVI并不适合对两种或更多类型的神经元群体电活动进行同时监测。
近日,来自耶鲁大学The John B. Pierce实验室的Madhuvanthi Kannan、Ganesh Vasan、Vincent A. Pieribone和斯坦福大学的Mark J. Schnitzer,在先前开发的绿色和红色荧光GEVI(Ace-mNeon和VARNAM,在细胞膜电位去极化时荧光减弱)的基础上[2, 3],进一步开发了灵敏度更高的下一代GEVI(Ace-mNeon2和VARNAM2),以及对应的具有相反响应极性的荧光GEVI——pAce和pAceR(在细胞膜电位去极化时荧光增强),相关结果发表于《科学》杂志[4]。
该研究中的新一代GEVI可在同一视野下对超过50个细胞(放电频率达0.4-1kHz)进行电活动监测,且在果蝇中的连续监测时间长达30分钟。
利用这一电压成像系统,理论上可同时记录多达四个不同的神经元类型,为首个可对不同类型神经元进行实时、亚毫秒级监测的技术。
论文首页截图
该研究团队在先前基于荧光共振能量转移(FRET,距离很近的两个荧光分子间产生的一种能量转移现象,供体荧光分子的发射光谱与受体荧光分子的吸收光谱重叠,并且两个分子的距离在10nm范围以内时,使得供体发生荧光猝灭)现象,将伞藻视紫红质(跨膜蛋白,FRET受体,具有电压敏感的光吸收谱)分别与荧光蛋白NeonGreen或mRuby3(FRET供体)融合,开发了Ace-mNeon和VARNAM两个GEVI,二者在神经元去极化时绿色或红色荧光减弱,使得可在活体中同时监测两种类型神经元的电活动[3]。
为了提高Ace-mNeon和VARNAM的电压敏感性,研究人员通过蛋白编辑技术(优化FRET供体与受体之间的连接)在人胚肾细胞中对两个GEVI的变体进行了高通量筛选,最终得到了对神经元电压变化更敏感的两个GEVI——Ace-mNeon2和VARNAM2。
紧接着,研究人员还筛选到了具有相反响应极性的两个GEVI——pAce和pAceR,它们在神经元去极化时,绿色或红色荧光增强。
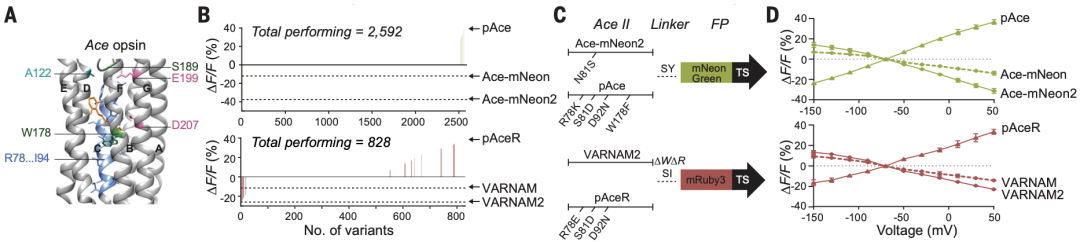
通过蛋白编辑技术和高通量筛选得到对神经元电压变化更敏感的两个GEVI以及具有相反响应极性的两个GEVI
除pAceR外,Ace-mNeon2、VARNAM2和pAce在室温条件下时间分辨率均达到了亚毫秒级,且对单个动作电位的有效荧光变化率(ΔF/F)比现有的正向或负向GEVI都高,具有良好的应用价值。
在体内测试中,研究人员首先在果蝇的Ppl1-γ2α’1多巴胺能神经元(会因气味诱发动作电位)中分别表达四种GEVI,发现绿色荧光GEVI相比于红色荧光GEVI,具有更大的响应变化幅度和d’值(荧光信号与背景波动的比,与检测保真度相关),且四种GEVI在PPL1-α’2α2神经元中显示出了比上一代指示蛋白Ace-mNeon和Varnam更高的d’值。
由于pAce具有较高的ΔF/F值和很好的光稳定性,其可连续记录长达30分钟的信号变化,并保持稳定的d’值。
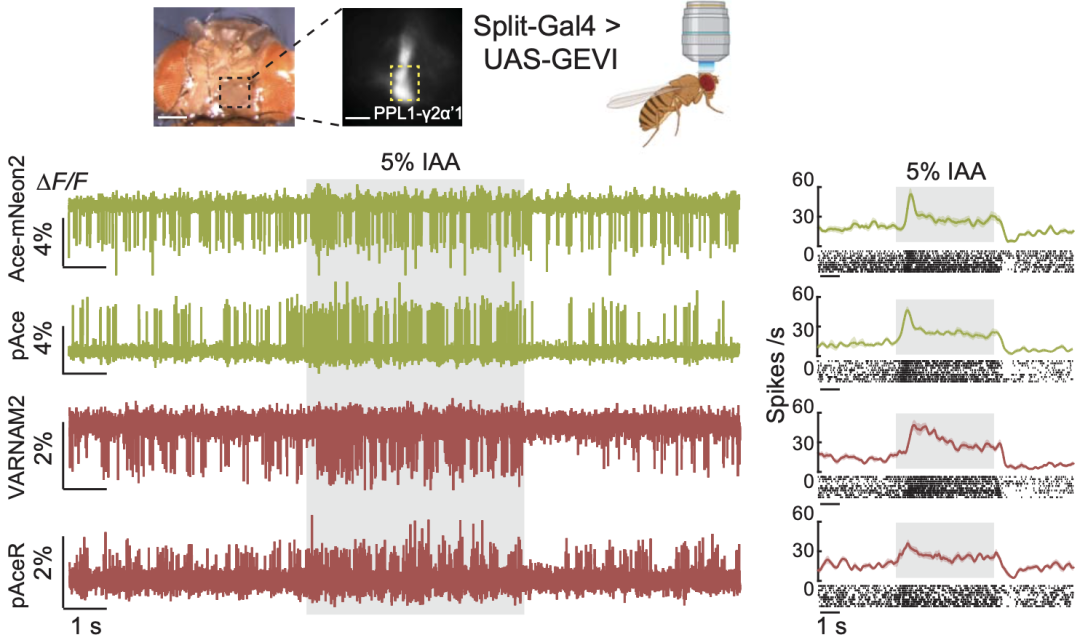
在果蝇内四种GEVI均可有效显示神经元电活动
随后,研究人员在小鼠初级视皮层(V1)的血管活性肠肽表达(VIP+)中间神经元中分别表达了四种GEVI,发现Ace-mNeon2、pAce、VARNAM2和pAceR的ΔF/F值分别为-16.5±1.9%、10.7±1.4%、-7.3±1.2%和3.2±0.5%,并具有高保真度。
有了“趁手的武器”,研究人员利用该成像体系对大脑工作机制进行了研究。
在大脑皮层中,中间神经元的活动受到动物状态的影响,进而调节相关神经元的兴奋性[5]。然而,不同类型的中间神经元对状态转换的反应程度,以及不同的大脑状态如何影响不同神经元亚型之间的相互作用仍是未知的。
为了解决这些问题,研究人员选择性地将Ace-mNeon2靶向表达到V1区的神经元源性神经营养因子阳性(NDNF+)、VIP+或生长抑素阳性(SST+)中间神经元,或V1→前内侧视觉皮质(AM)投射的椎体神经元(PNs)。
它们对清醒但头被固定的小鼠V1区电压成像显示,NDNF+神经元、VIP+神经元、SST+神经元、PNs的自发动作电位频率分别为4.72±0.01Hz、6.52±0.23Hz、4.71±0.21Hz和0.93 ±0.34Hz。
在向小鼠背部吹气提高小鼠觉醒程度后,各个神经元类型的动作电位均有所变化。在觉醒程度增加后,78%的SST+神经元增加了它们的自发动作电位频率,仅13%的SST+细胞自发动作电位频率降低,放电频率从基线下的2.5±0.4Hz增加到吹气后的22.5±1.2Hz。63%的NDNF+中间神经元也增加了它们的放电频率,从2.6±0.3Hz增加到16.8±0.7Hz,而28%的NDNF+神经元在吹气后降低了它们的放电频率。
VIP+神经元和PNs表现出类似的状态依赖反应,有约一半的细胞在吹气后表现出增加的放电频率,三分之一表现出减少的放电频率。
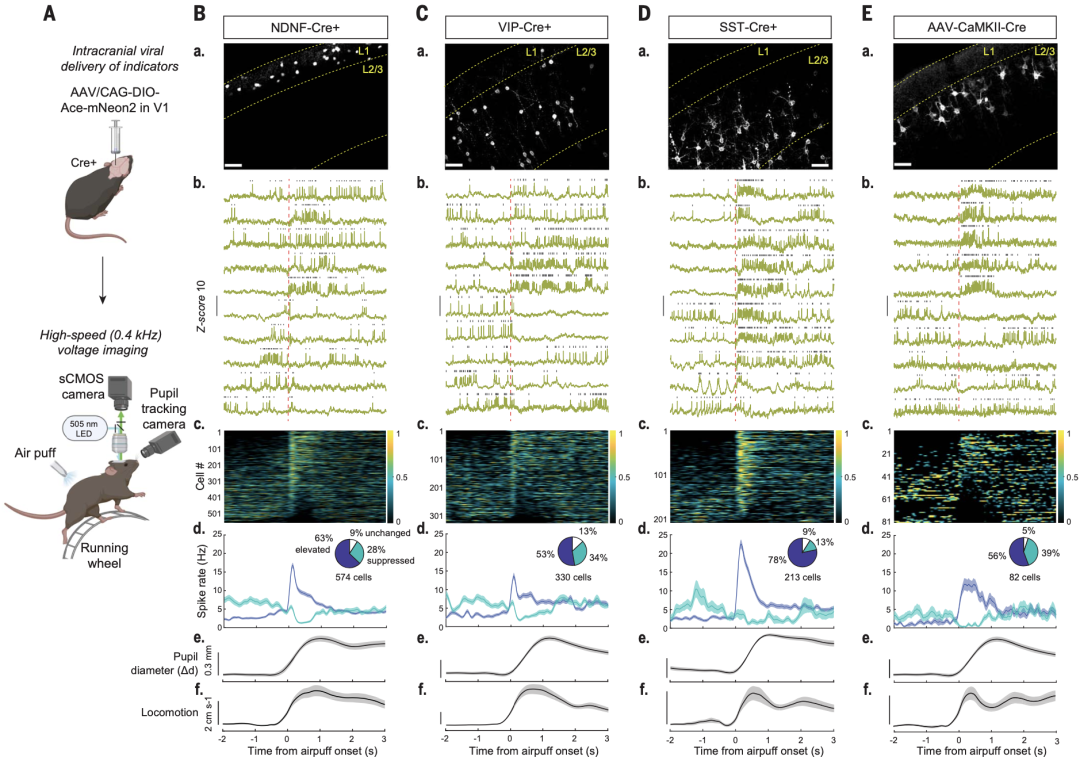
吹气前后不同神经元类型动作电位的变化
为了更精细地了解不同亚型神经元间的动态关系,研究人员在清醒的小鼠中进行了双极性多路电压成像(DUPLEX),分别将Ace-mNeon2和pAce靶向表达到两个不同的抑制性细胞类型或一个兴奋性一个抑制性细胞类型(NDNF+细胞和VIP+细胞或SST+细胞和VIP+细胞),以显示这些细胞对的协同作用。
研究结果显示,NDNF+和VIP+中间神经元的动作电位在群体内呈正相关,而群体间几乎不相关,表明这两种细胞类型可能接收不同的信号输入或双方不相互作用。相比之下,SST+和VIP+细胞群体间略呈负相关,表明SST+和VIP+神经元之间可能存在互相抑制作用。
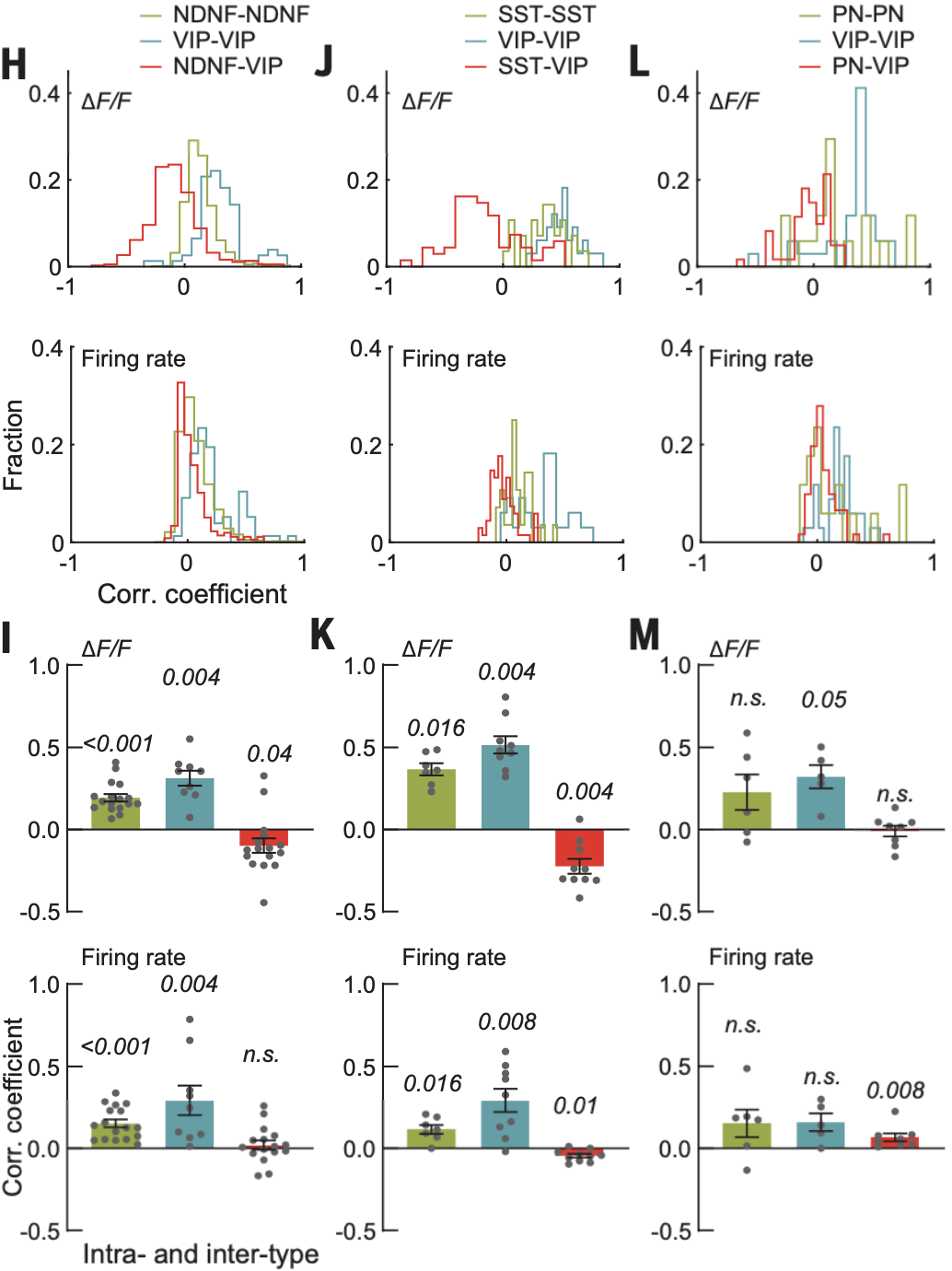
小鼠V1区不同神经元动作电位的相互关系
紧接着,研究人员对小鼠海马区不同的细胞类型进行了DUPLEX成像,评估了特定神经元类型和海马CA1的局部电位(LFP)之间的关系,他们发现在跑步状态的小鼠中,SST+细胞和内嗅皮质(EC)投射的PNs在其固有的θ(4-9Hz)膜电位的不同阶段放电,而EC投射的PNs的放电与LFP相位相同,表明LFP与EC投射的PNs的放电更相关。
最后,研究人员还利用该成像体系在小鼠中实现了对三种细胞群体电压变化的同时记录,同时捕捉到了EC投射细胞、侧间隔(LS)投射细胞和SST+细胞的电活动。研究人员推测,利用这四个GEVI,理论上可同时记录多达四个不同的神经元类型。
总的来说,本研究开发了两对极性相反的GEVI,且这四个GEVI相互兼容,可用于同时记录不同的神经元类型的电活动,对于神经科学的研究具有重要意义。


参考文献
1.Knopfel T, Song C: Optical voltage imaging in neurons: moving from technology development to practical tool. Nat Rev Neurosci 2019, 20(12):719-727.
2.Gong Y, Huang C, Li JZ, Grewe BF, Zhang Y, Eismann S, Schnitzer MJ: High-speed recording of neural spikes in awake mice and flies with a fluorescent voltage sensor. Science 2015, 350(6266):1361-1366.
3.Kannan M, Vasan G, Huang C, Haziza S, Li JZ, Inan H, Schnitzer MJ, Pieribone VA: Fast, in vivo voltage imaging using a red fluorescent indicator. Nat Methods 2018, 15(12):1108-1116.
4.Kannan M, Vasan G, Haziza S, Huang C, Chrapkiewicz R, Luo J, Cardin JA, Schnitzer MJ, Pieribone VA: Dual-polarity voltage imaging of the concurrent dynamics of multiple neuron types. Science 2022, 378(6619):eabm8797.
5.Ferguson KA, Cardin JA: Mechanisms underlying gain modulation in the cortex. Nat Rev Neurosci 2020, 21(2):80-92.

责任编辑丨BioTalker



















