今天给同学们分享一篇生信文章“A pan-cancer analysis shows immunoevasive characteristics in NRF2 hyperactive squamous malignancies”,这篇文章于2023年2月27日发表在Redox Biol期刊上,影响因子为11.4。

NRF2通路在各种癌症类型中经常被激活,然而目前缺乏对其在不同恶性肿瘤中的综合分析。作者开发了一个NRF2活性指标,并利用它对致癌性NRF2信号进行了泛癌分析。作者发现了一种免疫逃避表型,其中高NRF2活性与低干扰素-γ(IFNγ)、HLA-I表达以及鳞状恶性肿瘤的T细胞和巨噬细胞浸润相关。
1. NRF2活性评分提高了对NRF2驱动的恶性肿瘤的检测能力
作者从实验证实的稳定的NRF2靶基因中开发了一个NRF2活性评分指标(图1A)。这种评分的用途是克服使用黄金标准突变作为分类器的局限性,即样本量小和缺乏统计力量,以及罕见变异的功能不确定性。此外,还存在其他NRF2激活机制,强调了使用NRF2靶基因表达作为活性标记而不是体细胞变异的重要性。作者的目标是生成一个指标:a:基于对NRF2活性具有强有力响应的明显靶基因的表达;b:与组织无关;c:不偏向于来自肿瘤微环境的信号。评分的开发过程如下:首先,作者使用携带KEAP1失活突变G333W使NRF2过度活化的A549肺腺癌细胞(A549-NRF2 OE ),并用Cas9-sgNRF2敲除NRF2(A549-NRF2过表达与敲除的比较,以下简称A549-NRF2 OEvsKO )来检测NRF2依赖的差异表达基因。其次,作者使用公开可用的功能基因组学数据来筛选直接受NRF2调控的基因。第三,作者利用来自基因型组织表达门户网站(GTEx)和免疫细胞表达数据库(DICE)的公共组织以及基质细胞转录组数据,分别排除明显组织特异性或在肿瘤微环境人群中显著表达的基因。最终的NRF2特征包括基因CBR1、SRXN1、GCLC、GCLM、AKR1C3和ME1,最终得分定义为它们线性TMM归一化mRNA表达的几何平均值。得分值在TCGA样本中根据疾病实体进行了缩放(到密度分布峰值),以减少癌症类型之间的差异。
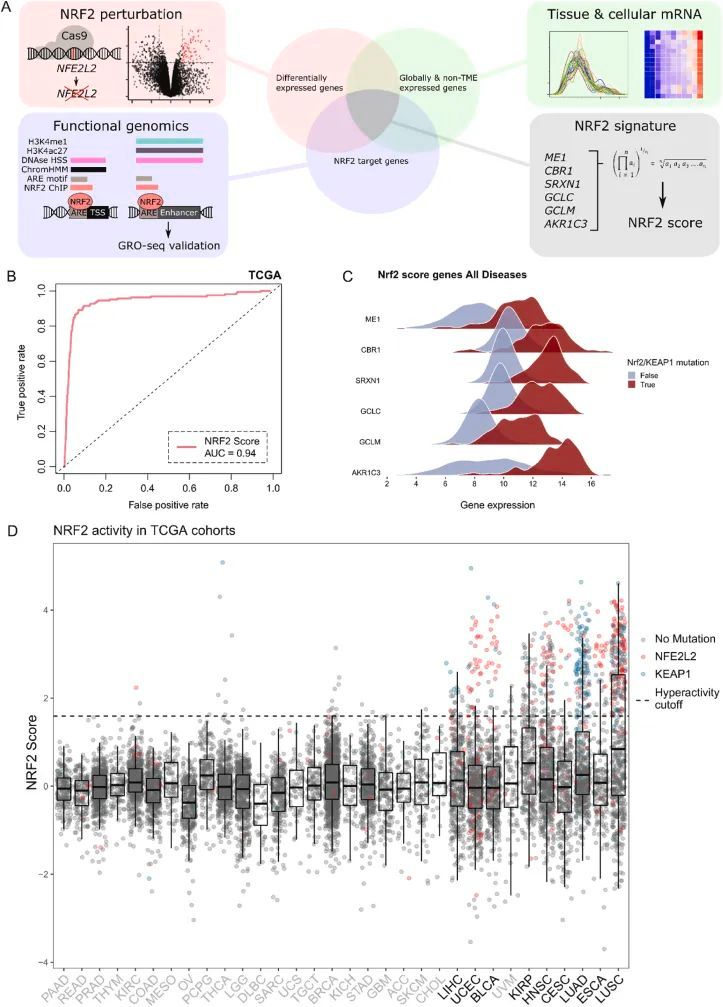
图1 NRF2评分的发展、性能和在TCGA恶性肿瘤中的分布
作者通过对OncoKB中定义的NFE2L2和KEAP1的热点以及TCGA数据中的功能性变异(KEAP1截断异常)进行ROC分析来评估得分表现(图1B)。得分表现出优秀的整体区分度(AUC = 0.94),基因在TCGA KEAP1/NFE2L2突变与野生型样本中的mRNA表达呈现明显不同的分布(图1C)。NFE2L2/KEAP1体细胞突变队列的个体ROC分析显示在图S1E中。作者计算了NRF2得分与NFE2L2 mRNA表达的相关性。根据相关模式,多种癌症类型显示出显著的正相关。由于经典的NRF2调控是基于蛋白质的周转,NFE2L2 mRNA的上调及其与靶基因表达的相关性表明存在上游调控因子的额外贡献。得分的变异与KEAP1/NFE2L2突变频率显著相关(r = 0.8,P < 0.0001),从而预测了NRF2的致癌性,无论激活机制如何。根据这个理论,与>5%的突变频率或σ 2 > 0相关的疾病。有75个被定义为具有显著的NRF2致癌活性。从这些恶性肿瘤中,作者舍弃了TCGA队列中N < 100的样本,以保持数据集的高统计功效。得分分布和队列选择如图1D所示。所有TCGA样本的NRF2活性得分列在附表3中。值得注意的是,肺部、子宫、膀胱、肾脏以及具有主导鳞状组织学的恶性肿瘤中,高得分样本的比例显著。
2. NRF2超活跃癌症中的丰富通路揭示了不同癌症类型之间的免疫调节关联差异
对于符合纳入标准的TCGA队列,以及A549-NRF2和CCLE转录组和蛋白质组数据,作者进行了基因集富集分析(GSEA),以评估与NRF2高活性相关的通路(图2A)。有趣的是,两条直接致癌的信号通路,MYC和WNT,显示出明显的全局正富集。与NRF2高活性相关的其他全局通路主要是代谢、药物外排和氧化还原调节过程,而与免疫微环境相关的过程在非小细胞肺癌和鳞状疾病中呈负富集,与其他疾病相比呈正富集。根据免疫环境相关基因集,通过策划的数据,队列被分成了两个群体。值得注意的是,在肺腺癌(LUAD)、肺鳞状细胞癌(LUSC)、食管癌(ESCA)、宫颈癌(CESC)以及头颈部癌症(HNSC)中,IFNγ反应、HLA和T细胞信号通路基因集在负端富集,而在肾乳头状细胞癌(KIRP)、子宫体内膜癌(UCEC)、膀胱癌(BLCA)和肝细胞癌(LIHC)中,这些通路的富集分数为正(图2A-B)。由于免疫基因集在纯细胞群体(A549-NRF2或CCLE)中没有富集,它们很可能是癌细胞和肿瘤微环境细胞之间的相互作用所产生的。值得注意的是,细胞因子、HLA-I、IL-12、IFNγ和TCR信号的下调都是“免疫冷”肿瘤的特征,这些肿瘤已经被证实对免疫检查点抑制疗法的反应较差。在进一步对定义的疾病组之间的差异通路进行特征化时,作者观察到肿瘤微环境相关富集术语的进一步差异(图2C)。由于这些途径主要由淋巴细胞相关的标志物组成,这些数据表明,在非小细胞肺癌和鳞状细胞疾病的背景下,致癌性NRF2信号与淋巴细胞浸润程度较低相关。数据还显示了NRF2与NSCLC和鳞状细胞癌与肾脏、子宫和肝脏癌之间的IFNγ反应和淋巴细胞相关途径富集之间的二分法关联。

图2 NRF2活性与特定疾病的免疫逃避特征相关
3. 鳞状疾病包括NRF2高活性亚型,具有SOX2扩增,CDKN2A/B和TP53缺失以及上调的免疫抑制基因
由于作者观察到TCGA鳞状疾病中存在相似的免疫冷特征,作者继续使用统一流形逼近和投影(UMAP)以及基于社区检测的聚类来研究疾病内的亚型效应。作者确定了一个具有高活性NRF2的独特全鳞状亚型(图3A显示了确定的社区,图3B显示了TCGA队列,图3C显示了NRF2活性)。与这个亚型相关的是,作者观察到共发生的拷贝数变异(CNV)和特征性的突变谱,尤其是SOX2/TP63的扩增(染色体3的q臂)和CDKN2A/CDKN2B的缺失(9p21)(图3D),以及突变的TP53和CDKN2A。此外,作者使用CCLE/DepMap数据集确定了一组具有相似基因组特征的细胞系,进一步证实了这个亚型的基因决定因素。染色体6中没有明显的高峰,这表明HLA-I丧失事件对表型没有贡献。为了确认这一点,作者将HLA-I的丧失定义为至少在主要HLA-I基因中发生一次浅层缺失或LoF突变,并且在Fisher's检验中没有观察到这两个变量之间的关联(OR = 0.40,P = 0.09)。肿瘤突变负荷和NRF2过表达的关联已经在之前的研究中报道过。因此,作者通过计算与NRF2活性相关的突变负荷(log2总突变计数)来评估不同新抗原负荷引起的免疫效应的前景,并且没有观察到突变计数和NRF2之间的统一趋势。为了跟进放大的转录因子SOX2和TP63,作者下载了公开可用的鳞状癌细胞系的ChIP-seq数据(GSE46837),并生成了一个目标基因列表,以研究这些转录因子的直接靶点。为了具体评估免疫调节基因中不同表达的潜在直接靶点,作者研究了鳞状细胞簇中不同表达基因与靶基因列表以及CellPhoneDB框架和TISIDB中的筛选基因的重叠情况(图3E)。从这些结果中,作者确定了SLC7A11、NAMPT、SLC2A1和MPP3是通过高通量筛选识别出的能够使T细胞免疫杀伤产生抗性的基因。此外,这些基因还有NRF2上游激活的证据。SLC7A11、NAMPT和SCL2A1是与代谢有关的基因,分别参与半胱氨酸摄取、NAD+生物合成和葡萄糖摄取。根据文献注释的基因,虽然大多数基因态度不明确,但SOX2在效应细胞耐药共培养情况下被证明是a)上调的;b)在体外下调IFN类型I反应;c)在HNSC小鼠模型中降低T细胞浸润[16]。有趣的是,作者观察到SOX2扩增的TCGA鳞状细胞癌(SqCC)病例中NFE2L2 mRNA增加,这表明Chr3 q2位点存在上游调控因子。最后,在鳞状NRF2簇中,作者发现IFNγ反应明显下调,类似于初始的GSEA分析(图3F)。综合这些数据,支持IFNγ反应和/或HLA-I基因的下调是NRF2或其他共表达转录因子(SOX2或TP63)的下游效应的观点。根据已确定的免疫调节基因的功能作用(图3E),肿瘤代谢环境的改变可能有助于NRF2高活性癌症的免疫逃逸。
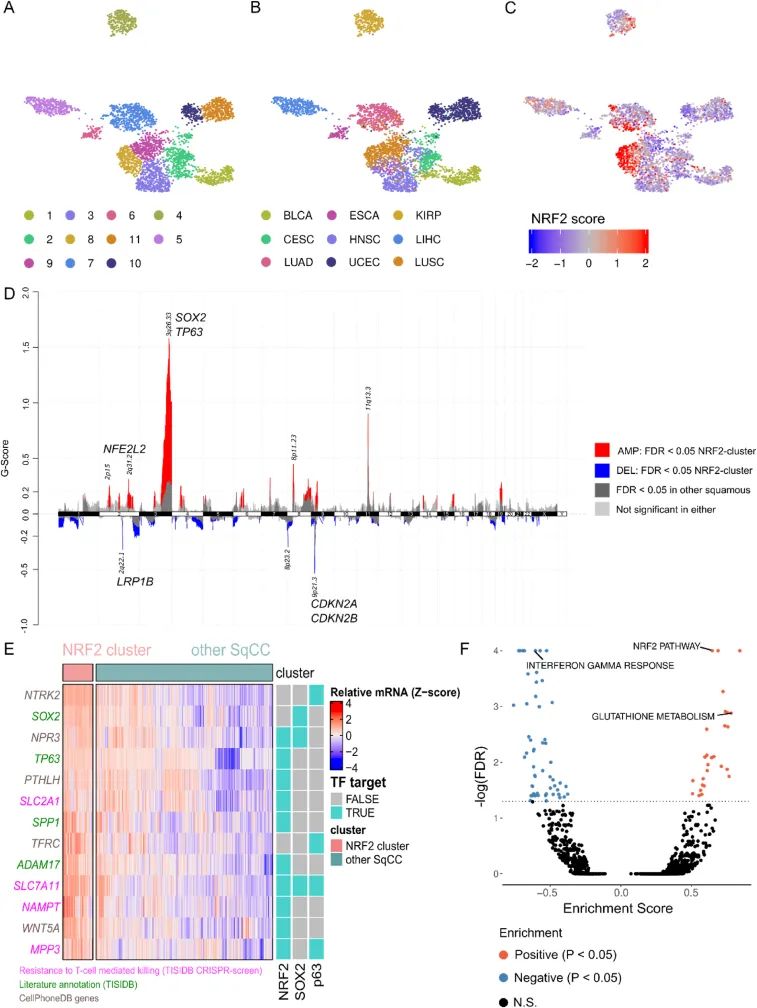
图3 NRF2的过度活跃与TCGA中的SOX2/TP63扩增、CDKN2A/CDKN2B缺失以及IFNγ反应下调相关联
4. NRF2超活跃的癌细胞在原位下调干扰素-γ反应途径
为了跟进已确定的目标,作者进一步探索了NRF2高活性癌细胞与免疫细胞之间的信号传导,以更高的分辨率在相关癌症类型的原位环境中进行研究。因此,作者为公开可用的HNSC单细胞RNA测序数据集(GSE103322)中的细胞分配了NRF2活性评分。单细胞的UMAP投影显示,在患者样本中,具有高NRF2评分的癌细胞呈现出明显的聚类,这表明NRF2的激活可能与细胞表型的全局变化相关(图4A和B)。与大块肿瘤类似,该聚类表现出高水平的SOX2表达(图4C)。此外,TP63在NRF2高活性癌细胞聚类中也过度表达,尽管其表达也存在于其他聚类中。与大块肿瘤分析进一步一致的是,炎症反应和IFNγ信号通路是相对于其他癌细胞聚类而言在NRF2聚类中最显著的负富集通路(图4D)。单细胞分析表明,对干扰素的响应在具有NRF2高活性的恶性细胞中被下调。这些数据表明,干扰素γ反应与鳞状癌类型中的NRF2之间的负相关性源于癌细胞的反应,要么是由于干扰素配体较低,要么是由于NRF2高活性癌细胞的内在特性。
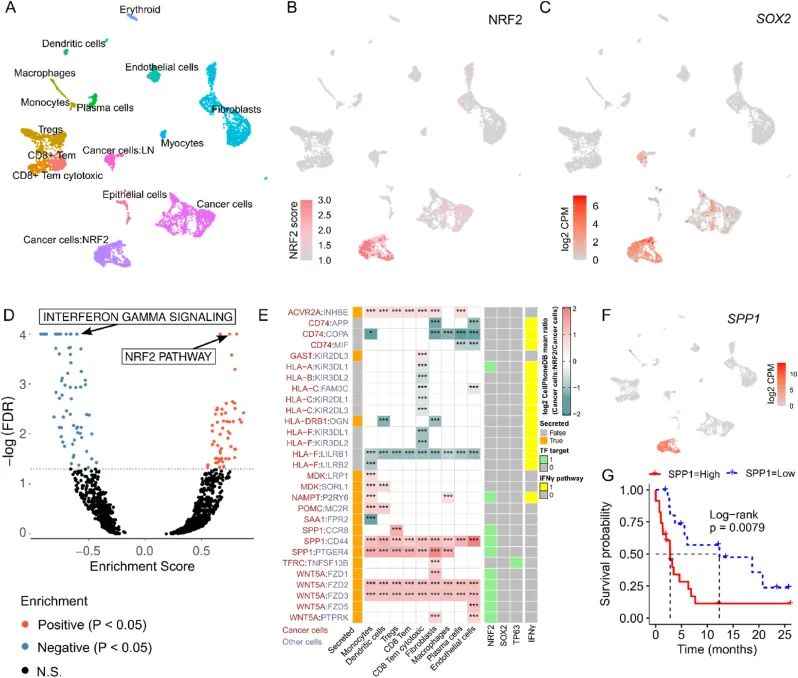
图4 NRF2过度活跃的癌细胞在原位具有抑制的IFNγ反应,并展示出独特的免疫调节细胞内相互作用
5. NRF2过度活跃的癌细胞与HLA-I的TME相互作用较少有关,而与NAMPT、SPP1和WNT5A的相互作用增加有关
作者使用CellPhoneDB的统计框架来研究整个HNSC单细胞数据集中癌细胞和TME细胞之间的潜在细胞间配体-受体相互作用。通过整合作者的NRF2靶基因目录和来自MSigDB(Hallmarks和Reactome)的先验IFNγ基因集,作者确定了癌症聚类与TME聚类之间的多个差异性相互作用,这些相互作用要么是直接的NRF2靶基因,要么是参与IFNγ介导信号传导的基因。最显著的结果是HLA I型与细胞毒性T细胞的相互作用下调,而NAMPT、SPP1、WNT5A上调(图4E和F)。这些结果也是早期全SqCC肿瘤分析和CCLE细胞系mRNA中的差异表达基因,而SPP1和WNT5A蛋白也上调。此外,NAMPT和SPP1在A549中差异表达,并且所有结果都在作者的NRF2靶基因目录中。此外,与早期观察一致,NRF2高活性癌细胞与T细胞之间的PD-L1 - PD1相互作用在统计学上具有显著意义,进一步证实了PD-L1在NRF2驱动的免疫逃逸中的作用,并暗示其效果扩展到先前研究的黑色素瘤。从直接靶点来看,NAMPT是NAD+生物合成中的限速酶。虽然CellPhoneDB中推断其与P2RY6的相互作用是通过蛋白质拉下实验得出的,但缺乏功能数据,最近的研究表明,NAMPT敲除可通过减弱诱导性PD-L1表达来增加小鼠肿瘤中CD8 T细胞的浸润。第二个命中目标是骨桥蛋白(SPP1),已经证明其能够抑制体外T细胞增殖和IFNγ产生。第三个命中目标是WNT5A与Frizzled受体的结合,也与肿瘤免疫有关:WNT5a信号在癌细胞中通过FZD诱导树突状细胞产生免疫抑制代谢产物。为了评估这些发现的临床相关性,作者下载了一份公开可获取的PD-1抑制剂治疗HNSC和NSCLC患者的靶向mRNA表达数据集,并将SPP1 mRNA确定为治疗反应的负预测生物标志物(高SPP1表达的反应比= 0.20;P < 0.05,Fisher's检验),以及与治疗相关的无进展生存期(mPFS 2.8 vs mPFS 12.33个月,P < 0.01)在pan HNSC-LUSC-LUAD(分别为n = 5;n = 22;n = 13)(图4G)。较差的生存可能是由于SPP1的效应直接引起的,也可能是由于NRF2激活引起的,其中SPP1 mRNA充当了替代标志物。这一临床观察可能在对ICB的非响应者进行分类时具有相关性,因为目前的生物标志物缺乏可靠性。总之,这些数据表明,NRF2高活性的癌细胞过度表达了与肿瘤微环境相互作用的独特配体NAMPT、SPP1和WNT5A,这些配体已被证明在癌症中引起免疫逃避。
6. NRF2的过度活跃与鳞状癌中间质淋巴细胞和巨噬细胞浸润减少以及可诱导的癌细胞PD-L1表达增加相关
最后,为了更详细地探索NRF2活性与免疫环境之间的关系,作者使用CIBERSORT 对TCGA基因表达数据进行解卷积,以推断免疫细胞含量,并将细胞分数与NRF2得分相关联。在NRF2高活性的IFNγ阴性恶性肿瘤中(图5A,以军校蓝色编码的队列),许多淋巴细胞群体和不同的巨噬细胞极化状态与NRF2活性呈负相关,而细胞亚群的相关性在癌症类型之间有所变化。在NRF2高活性的IFNγ阳性癌症中(以珊瑚色编码的队列),作者观察到与不同免疫细胞呈正相关的情况较多,并且在相关的细胞类型之间存在差异:在KIRP中,与巨噬细胞有很强的关联,在UCEC中与其他抗原呈递细胞有关(图5A)。不同的恶性肿瘤在其免疫细胞含量上存在差异。因此,作者使用Mann-Whitney U检验比较了IFNγ响应筛选出的NRF2高活性癌症中各种免疫细胞的整体分布情况,观察到NRF2高活性的IFNγ阴性恶性肿瘤往往具有更高的疾病内在免疫细胞比例,包括巨噬细胞、淋巴细胞和树突状细胞(图5A,侧面板)。为了评估NRF2和总T淋巴细胞含量之间的关系,作者计算了T细胞分数的总和,并观察到所有IFNγ阴性的NRF2高活性癌症中淋巴细胞的数量较少(图5B)。作者继续利用从TCGA H&E图像中生成的公开可用的TIL数据集和深度学习的不同方法验证了这一结果,并观察到NRF2高活性病例中肿瘤浸润淋巴细胞(TILs)的中位数百分比下降(P < 0.05,图5C)。为了证实这一点,作者使用NQO1(NRF2活性的标记物)和通用T细胞标记物CD3,对一个独立的非小细胞肺癌(NSCLC)组织微阵列数据集进行染色(该数据集来自Auria生物库,分别包含117例LUSC和211例LUAD),在LUSC中观察到了类似的结果,即NQO1阳性肿瘤(超过平均强度分布的上四分位数)中的CD3细胞较少(P < 0.05,图5D和E)。在作者的TMA数据中,细胞毒性T细胞标记物CD8显示了类似的趋势,但没有达到统计学意义(P = 0.09),而在LUAD中没有观察到这种关系(数据未显示)。此外,作者还单独评估了TCGA LUSC队列中NFE2L2和KEAP1突变的贡献,并发现无论基因是否突变,所有组中的总淋巴细胞浸润中位数分数都较低。由于早期的方法不能区分间质和上皮浸润人群(定义为恶性上皮成分内的细胞),作者接下来使用多重免疫组化(mIHC)评估了NRF2活性与上皮内免疫细胞之间的关系。在另一个NSCLC切除病例的独立队列中(从芬兰中部生物库获得,经过质量控制过滤后的最终样本量分别为LUSC和LUAD的67和53),作者使用AKR1B10作为NRF2激活的标志物。令人惊讶的是,作者在LUSC和LUAD中并未观察到上皮内群体的差异,除了AKR1B10高表达的LUSC中含有更少的上皮内粒细胞。然而,在LUSC中,总核心区域的基质群体密度,即CD8和CD4阳性T细胞以及M2巨噬细胞和粒细胞,均减少(图5G和H)。预期地,肿瘤纯度,即相对肿瘤面积与总面积的比值与NRF2活性呈正相关(图5I)。作者使用TCGA的绝对定量结果对此结果进行了验证。在其余的NRF2免疫冷的TCGA癌症类型中,如HNSC、CESC、ESCA和LUAD,也观察到了对肿瘤纯度的类似影响。在LUAD的多光谱免疫组织化学中,作者并未观察到淋巴细胞的差异,但AKR1B10高表达组中未指定的巨噬细胞较少。此外,LUAD AKR1B10高表达组的肿瘤纯度较高,但在统计学上没有显著差异。有趣的是,在LUSC基质巨噬细胞中,PD-L1阳性细胞的比例与癌细胞AKR1B10的平均表达呈显著相关(图5J和K)。鉴于基质巨噬细胞的观察效果以及PD-L1作为NRF2的下游靶点的早期观察结果,作者想知道NRF2活性是否会对LUSC中可诱导的PD-L1表达起作用。在癌细胞中,上皮内CD8 T细胞浸润(E-CD8)与PD-L1表达呈正相关,这是来自近端促炎信号的预期效应。鉴于这种基线效应,作者将样本分为浸润和无浸润的情况(即,CD8细胞密度高且靠近癌细胞),观察到在浸润样本中,癌细胞AKR1B10的平均表达与PD-L1阳性癌细胞的比例呈正相关(R = 0.69,P < 0.001,图5L-M)。癌细胞AKR1B10与PD-L1表达之间的相关性在低E-CD8 + 中不存在,这表明需要促炎刺激来诱导NRF2驱动的PD-L1。值得注意的是,这些E-CD8 + 浸润样本中只有一个超过了作者的截断值,被定义为NRF2高活性(强度为180 A U.),而E-CD8 + 浸润样本的比例低于25%。为了证实PD-L1和NRF2之间的正向关联,作者计算了TCGA LUSC中NRF2基础组和高活性组之间的纯度校正CD274 mRNA,并观察到NRF2高活性组的中位数表达增加(P < 0.0001)。作者在LUAD中的mIHC数据和TCGA中没有发现NRF2和PD-L1之间的类似关联(未显示数据)。NRF2信号对LUAD的免疫环境的影响仍然大部分不明确,因为作者的数据没有显示出组间的类似差异。然而,在其他TCGA鳞状癌中存在PD-L1的关联。综合这些数据,可以推测过度活跃的NRF2与全面的间质细胞浸润在全面鳞状细胞癌中相关,主要表现为淋巴细胞和巨噬细胞密度降低以及肿瘤间质细胞占据面积减少。TMA数据和肿瘤纯度的关联表明,在TCGA解卷积数据中观察到的差异可能特别来自占据间质的人群,这是预期的,因为大部分免疫细胞寄居在间质而不是上皮组织中。此外,这些结果表明,总体PD-L1表达与增加的癌细胞NRF2活性相关,无论是在癌细胞还是间质巨噬细胞中,这表明在NRF2过度活跃的LUSC的间质和肿瘤景观中存在全球PD-L1免疫抑制环境。CD274 mRNA表达分布暗示这种效应延伸到其他鳞状恶性肿瘤。
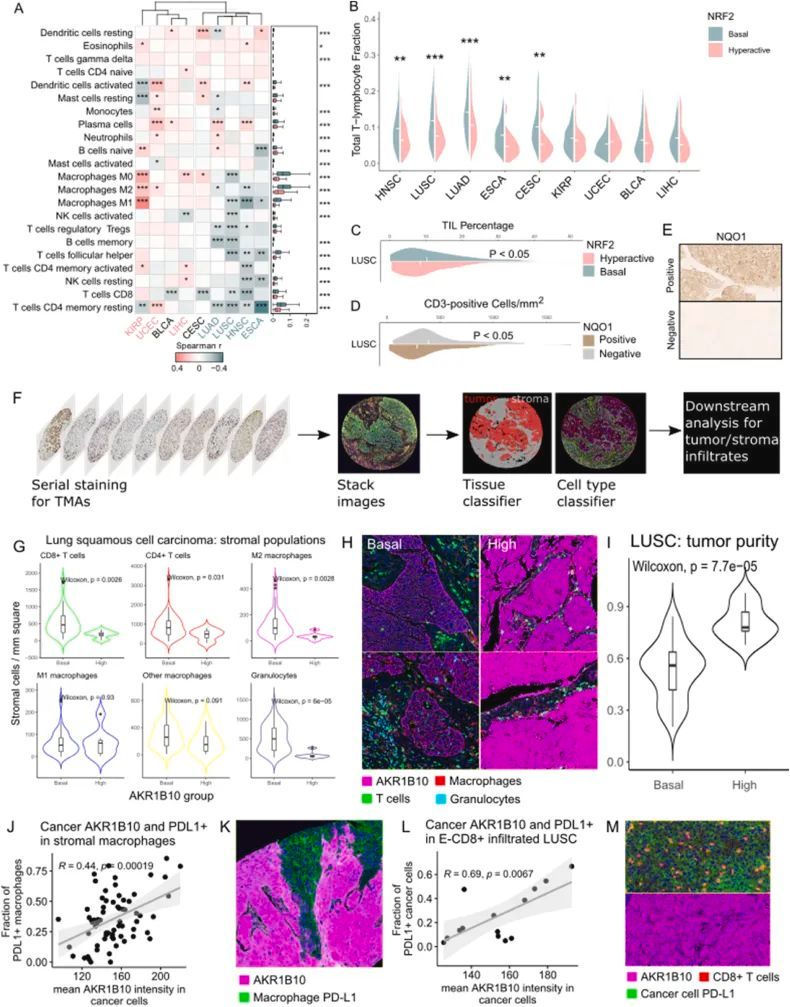
图5 NRF2过度活跃的肿瘤与全身淋巴细胞在全鳞状疾病中呈负相关
总结
总之,作者的研究结果为癌症生物学提供了一个集成的以NRF2为中心的资源,并从泛癌范围的角度建立了免疫冷瘤与NRF2信号传导之间的联系,这涉及到鳞状细胞癌。最后,这些数据突出了未来研究中追求机械性地表征NRF2信号传导及其对肿瘤免疫环境的影响的多个途径,包括通过免疫抑制配体或免疫抑制代谢物的直接调控。



















