来源:生物通
日本科学家利用干细胞来诱导生殖细胞,从而产生健康且可生育的后代。
不久前,日本京都大学(Kyoto University)的研究人员在《细胞干细胞》(Cell Stem Cell)杂志上发表了一篇研究论文,称他们利用小鼠多能干细胞在试管中逐渐分化成有功能的精子。
而且,这些精子被成功地用于给雌鼠授精,并成功地产下了健康、可育的后代。这为在试管中产生雄性生殖细胞提供了一个全面的范例和模型。
然而,除了小鼠,到目前为止,在附近的其他哺乳动物中还没有类似的报告。
2022年4月7日,东京大学干细胞与再生医学研究中心科研团队在顶级期刊《Science》上发表了题为《从多能干细胞中提取的功能性原始生殖细胞样细胞》的研究文章。
在前期对大鼠生殖细胞发育的分子机制分析的基础上,他们成功地利用大鼠多能干细胞诱导功能性原始生殖细胞样细胞(PGCLCs),并将这些原始生殖细胞样细胞移植到无菌细胞中。
在大鼠的输精管中,可以产生功能性精子,从而产生健康的后代。
在哺乳动物中,原始生殖细胞(PGCs),精子和卵子的前体,产生于前肠胚胎。先前使用转基因小鼠等工具的研究已经揭示了对PGCs命运决定至关重要的关键信号通路和转录调节因子。
然而,在早期胚胎发育中的PGCs数量相对较少,这限制了该领域对其进入特殊生殖细胞的特定时间窗口的理解。
胚胎植入后,大鼠胚泡形成一个包含多能外胚层的卵囊结构,胚泡由外胚层产生生殖细胞,与小鼠胚泡相似。因此,研究人员首先测试了大鼠多能干细胞(rPSCs)向上皮样细胞(EpiLC)的命运转换是否可以在之前建立的小鼠培养条件下实现。
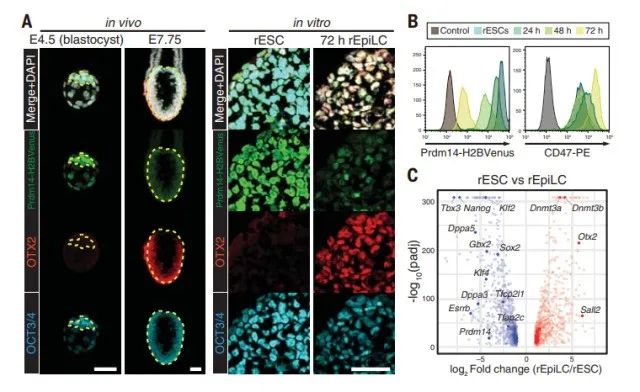
为了监测从多能状态的转变,他们使用Prdm14-H2BVenus标记的大鼠胚胎干细胞(rESCs),这是幼稚多能外胚层和ESCs的Prdm14-H2BVenus标记物,但不是胚胎植入后形成的外胚层。
培养72小时后,染色显示Prdm14-H2BVenus水平下降,OTX2(植入后外胚层的标记物)和CD47(小鼠外胚层干细胞中上调的质膜标记物)水平升高,核心多能因子OCT3/4水平保持稳定。
随后,为了研究培养后产生的大鼠上皮样细胞(rat epithelial - oid cells, rEpiLCs)的整体基因表达,他们对rESCs和rEpiLCs进行了全转录组测序,两者的差异分析显示,两组均含有幼稚或primed细胞。
两个状态相关基因。结合上述实验结果,他们证实了幼稚-rESCs在体内再现了植入后外胚层的特征。
接下来,他们使用分离的RESC在EpiLC培养基中培养48-72小时以形成聚集体,然后将聚集体转移到含有BMP4的PGC样细胞(PGCLC)培养基中,BMP4是影响PGC命运的重要细胞因子。
在PGCLC培养基中培养2天后,聚集体中的一部分细胞开始表达高度保守的生殖细胞标记基因Nanos3。
然后,他们对培养第3天rPGCLCs(d3 rPGCLCs)的转录组进行测序,并将其与RESC、rEpiLCs、大鼠外胚层和活体rPGCs的转录组进行比较。
主成分分析(PCA)结果反映了在体内和体外,外胚层向种系命运的转变。
所有PGC特异性基因和多能性基因均在第3天的rPGCLCs中表达,而晚期PGC标记物的表达低于E15.5个性腺rPGCs。
因此,他们推断,诱导的RPGCLs可能对应于rPGCs在体内的迁移阶段。
由于PGC在发育过程中经历了广泛的表观遗传重编程,他们还研究了培养细胞中DNA甲基化和组蛋白甲基化动力学的变化。
结果表明,培养过程中的表观遗传学变化动态与rPGCs在体内的发育密切相关,表明d3 rPGCLCs在体外随着表观遗传学重编程的逐渐进行在性腺阶段逐渐成熟。
最后,他们研究了体外诱导的雄性rPGCLCs在体内移植后是否能产生功能性精子。
他们将rPGCLCs移植到完全缺乏内源性生殖细胞的Prdm14基因敲除新生大鼠的生精小管中,并在移植后8-11周检测移植睾丸输精管中示踪基因的表达。
同时,在组织切片中,他们还观察到圆形精子细胞和成熟精子,这些结果表明rPGCLCs可以在体内完成精子发生和成熟的过程。
最后,他们研究了体外诱导的雄性rPGCLCs是否能在体内移植后产生功能性精子。
接下来,他们将诱导的圆形精子细胞和成熟精子分别注入未受精的大鼠卵母细胞,以证明rPGCLCs衍生的睾丸生殖细胞的发育潜力。
足月移植后,分别有18只和6只健康大鼠后代出生并发育成可生育的正常成年大鼠。因此,这些结果表明,体外诱导的rPGCLCs能够产生功能完整的成熟配子。
在体外从多能干细胞转化为生殖细胞,并在体内生产健康后代,一直是生殖医学和动物育种科学关注的焦点。
近10年前,它在小鼠身上取得了成功,但在任何其他物种中,都没有在体外使用PGCLCs在体内诱导配子产生,Mami Oikawa及其同事将这种能力扩展到了大鼠身上。
由于大鼠在生理上比小鼠更像人类,因此本研究报告的体外配子发生系统具有更广泛的适用性,可以进一步用于研究各种遗传疾病和疾病的致病作用。
大鼠模型的进展也将使我们更接近于建立适用于牲畜繁殖和生殖医学中其他物种的系统。
“这项研究代表了哺乳动物种系生物学快速发展的另一个例子,证明了利用多能干细胞和诱导多能干细胞(例如,皮肤细胞)制造大鼠配子的可能性。”剑桥大学教授Surani Azim 说:“我们离人类干细胞的人类配子远不远。然而,像这样的研究促进了生殖系生物学的知识,并帮助我们找到解决不孕和缓解人类生殖障碍的方法。”
参考文献
1. Mami Oikawa., et al., Functional primordial germ cell–like cells from pluripotent stem cells in rats. Science (2022).
2. Kobayashi T, et al., Germline development in rat revealed by visualization and deletion of Prdm14. Development (2020).
3. Yamashiro C, et.al., Generation of human oogonia from induced pluripotent stem cells in vitro. Science (2018).
未来智能实验室的主要工作包括:建立AI智能系统智商评测体系,开展世界人工智能智商评测;开展互联网(城市)大脑研究计划,构建互联网(城市)大脑技术和企业图谱,为提升企业,行业与城市的智能水平服务。每日推荐范围未来科技发展趋势的学习型文章。目前线上平台已收藏上千篇精华前沿科技文章和报告。
如果您对实验室的研究感兴趣,欢迎加入未来智能实验室线上平台。扫描以下二维码或点击本文左下角“阅读原文”




















