
导语
今天给同学们分享一篇生信文章“Dissection of pyroptosis-related prognostic signature and CASP6-mediated regulation in pancreatic adenocarcinoma: new sights to clinical decision-making”,这篇文章发表在Apoptosis期刊上,影响因子为7.2。

结果解读:
在胰腺导管腺癌中识别PRGs的表达
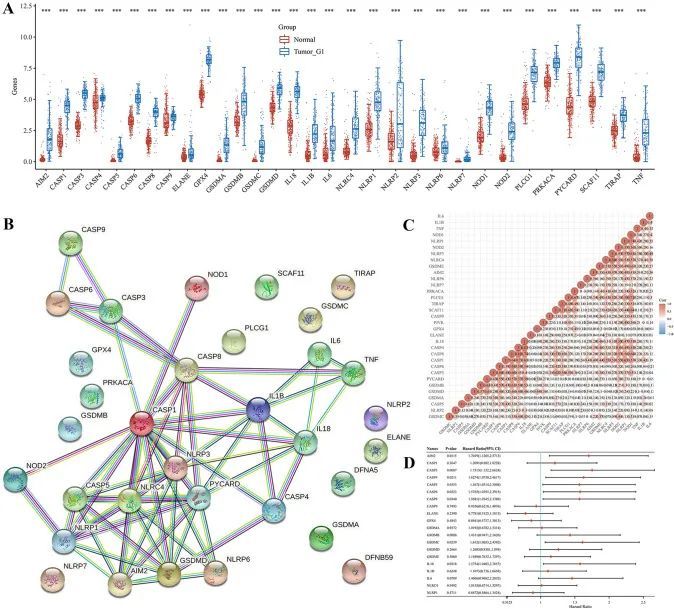
作者使用TCGA和GTEx数据集在PAAD和正常组织中鉴定了33个PRGs的表达情况,结果显示有31个基因上调,而另外两个基因(GSDME和PJVK)未被检测到(图1A)。根据STRING数据库,PPI网络显示AIM2、PYCARD、CASP1、CASP5、CASP8、GSDMD、NLRC4、NLRP1和NLRP3是关键基因(图1B)。通过相关性分析确定了这些基因之间的相互关系(图1C)。
PRGs的功能富集分析
为了阐明PRGs的作用,使用Metascape进行了GO和KEGG分析。GO分子功能分析显示,33个PRGs主要与半胱氨酸型内切肽酶活性、特定蛋白结构域结合、磷脂酰肌醇-4,5-双磷酸结合、细胞因子受体结合以及caspase活化和招募结构域结合相关。GO生物过程分析表明,33个PRGs主要参与火焰杆菌感染、对细菌的反应、白细胞介素-1β产生的正调控、对脂多糖的反应以及凋亡信号通路。作者还发现,在GO细胞组分分析中,这33个PRGs主要参与炎症小体复合物、细胞体、吞噬小泡和分泌颗粒腔。KEGG通路分析显示,这33个PRGs与NOD样受体信号通路、沙门菌感染、结核病、凋亡以及中性粒细胞外陷阱形成相关。
构建和评估PRGs预测基因特征
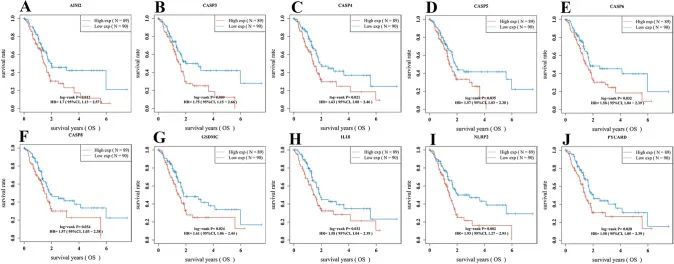
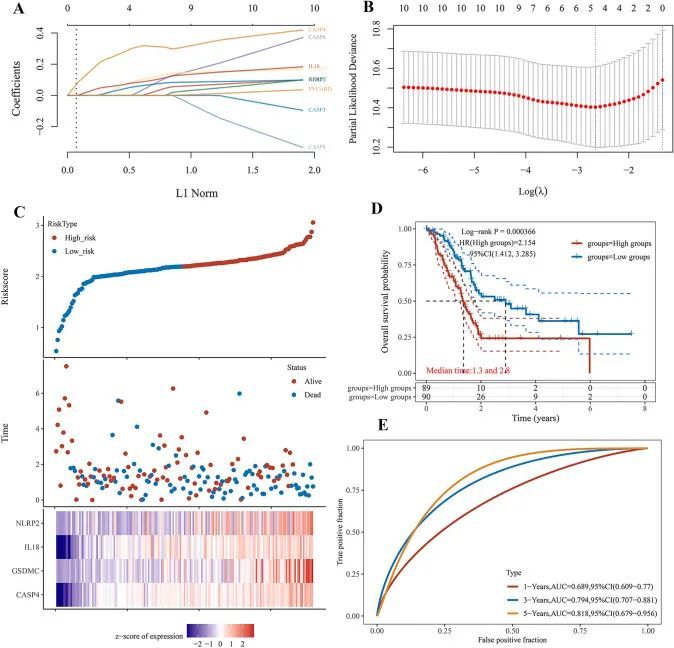
使用单变量Cox回归分析评估PAAD患者PRGs的预后。作者确定了10个具有临床预后价值的基因:AIM2,CASP3,CASP4,CASP5,CASP6,CASP8,GSDMC,IL18,NLRP2和PYCARD(图1D)。此外,Kaplan-Meier曲线显示,PAAD患者中AIM2(图2A,P = 0.012),CASP3(图2B,P = 0.009),CASP4(图2C,P = 0.021),CASP5(图2D,P = 0.035),CASP6(图2E,P = 0.032),CASP8(图2F,P = 0.034),GSDMC(图2G,P = 0.024),IL18(图2H,P = 0.032),NLRP2(图2I,P = 0.002)和PYCARD(图2J,P = 0.028)表达低的患者存活时间较长。基于上述预后基因,作者使用LASSO Cox回归建立了一个新的PRG签名(图3A,B)。根据中位风险评分,将PAAD患者分为低风险组和高风险组。作者发现较高的风险评分与死亡风险增加相关(图3C)。接下来,Kaplan-Meier曲线显示,低风险组的PAAD患者预后较高风险组更好(图3D,P < 0.001,HR 2.154,95%CI 1.412-3.285)。此外,作者进一步使用ROC曲线研究了生存概率,结果显示在1年时曲线下面积为0.689(95%CI 0.609–0.770),在3年时为0.794(95%CI 0.707–0.881),在5年时为0.814(95%CI 0.679–0.956)(图3E)。
Nomogram的开发和校准
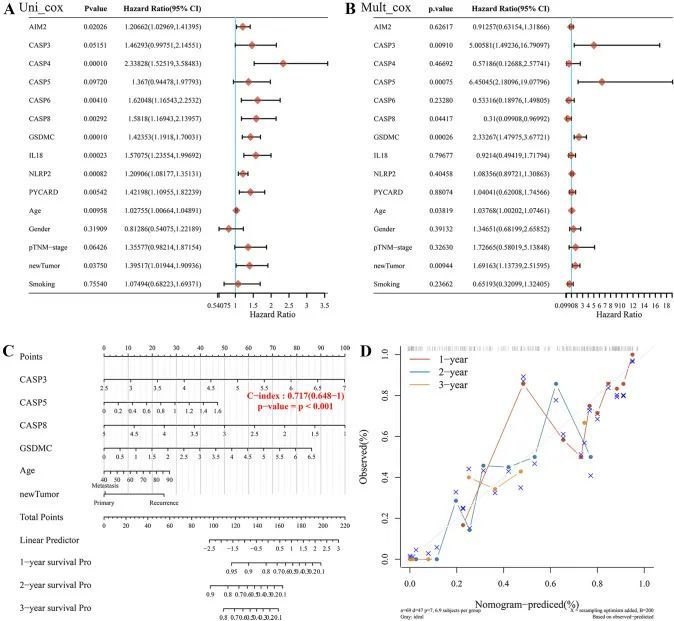
结合预后相关基因(PRGs)和临床病理特征,作者实施了一个预测性诺模图来预测生存概率。单变量和多变量回归分析显示CASP8、GSDMC、年龄和新肿瘤类型是影响PAAD患者预后的独立因素(图4A、B)。然后,作者基于CASP3、CASP5、CASP8、GSDMC、年龄和肿瘤状态构建了一个临床预测诺模图。诺模图表明1年、3年和5年的生存概率具有强大的预测性能。此外,校准曲线与诺模图显示出良好的一致性(图4C、D)。
TMB、免疫检查点和免疫浸润的分析
证据表明,TMB是癌症的预测性生物标志物。如图5A所示,作者发现这些预后10个基因与各种免疫抑制剂和激活剂呈正相关,除了CASP6。作者还调查了这些预后基因与PAAD中TMB之间的相关性,以评估PRGs在免疫治疗中是否起到重要作用。结果显示,TMB与CASP3呈正相关(图5C,P = 0.024),与CASP5呈正相关(图5E,P = 0.012),与CASP6呈正相关(图5F,P = 0.000135),与CASP8呈正相关(图5G,P = 0.035),与IL18呈正相关(图5I,P = 0.014),与PYCARD呈正相关(图5K,P = 0.001),但与其他AIM2无显著关系(图5B,P = 0.377),与CASP4无显著关系(图5D,P = 0.139),与GSDMC无显著关系(图5H,P = 0.868),与NLRP2无显著关系(图5J,P = 0.783)。此外,作者评估了预后PRGs中免疫浸润细胞的价值。作者观察到AIM2表达与B细胞(P = 9.35e−7)、CD8 + T细胞(P = 1.61e−3)、CD4 + T细胞(P = 6.95e−8,cor = 0.4)、巨噬细胞(P = 1.98e−5)、中性粒细胞(P = 1.65e−8)和树突状细胞(P = 2.73e−12)的丰度呈正相关(图S1A)。CASP3(图S1B)、CASP4(图S1C)、CASP5(图 S1D)和CASP8(图S2A)的表达与CD4 + T细胞的免疫浸润相关。此外,CASP6的表达与B细胞(P = 6.94e−3)、CD8 + T细胞(P = 4.91e−4)和树突状细胞(P = 3.35e−2)呈正相关,与CD4 + T细胞(P = 3.97e−2)呈负相关(图S1E)。GSDMC(图S2B)和IL18(图S2C)的表达与CD8 + T细胞、中性粒细胞和树突状细胞呈正相关。PYCARD与CD8 + T细胞(P = 2.14e−3)和巨噬细胞(P = 4.73e−4)呈负相关,与CD4 + T细胞(P = 1.13e−3)呈正相关(图S2E)。然而,NLRP2的表达在免疫浸润细胞之间没有显著差异(图S2D)。这些结果表明PRGs与肿瘤免疫浸润之间存在显著相关性。
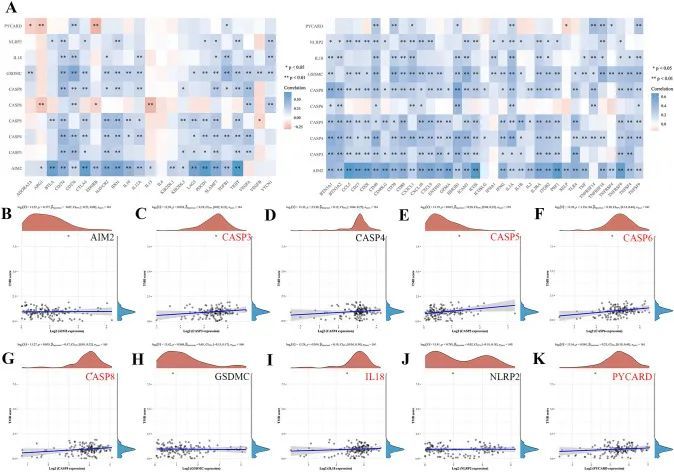
CeRNA(长链非编码RNA-微小RNA-信使RNA)调控轴的鉴定
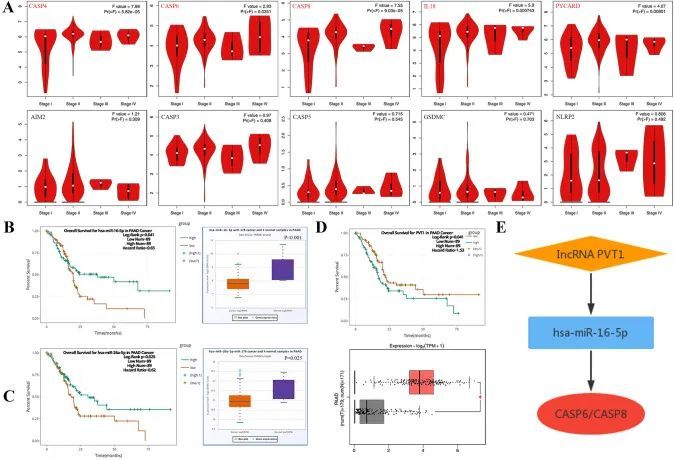
首先,作者阐明了预后相关基因(PRGs)与临床分期之间的关联(图6A)。结果显示,临床分期与CASP4(P = 5.82e−5)、CASP6(P = 0.0351)、CASP8(P = 9.03e−5)、IL18(P = 0.000743)和PYCARD(P = 0.00801)密切相关,但与AIM2(P = 0.309)、CASP3(P = 0.408)、CASP5(P = 0.545)、GSDMC(P = 0.703)和NLRP2(P = 0.703)无关。基于以上五个显著基因,作者使用TarBase V.8数据库预测上游miRNA,获得94个mRNA-miRNA对(附表2)。作者进一步使用starBase数据库评估了这些预测miRNA在胰腺导管腺癌(PAAD)中的表达和预后情况,发现只有hsa-miR-16-5p(CASP6和CASP8的上游miRNA)(图6B,P < 0.001)和hsa-miR-26a-5p(PYCARD的上游miRNA)(图6C,P = 0.025)与PAAD患者的不良生存率相关(图6B,P = 0.041,图6C,P = 0.025)。此外,作者使用miRNet数据库探索了hsa-miR-16-5p和hsa-miR-26a-5p的上游lncRNA,并确定了155个miRNA-lncRNA对(附表3)。最后,作者使用GEPIA和starBase数据库分析了这些lncRNA在PAAD中的表达和预后情况。结果显示,仅PVT1(hsa-miR-16-5p上游长链非编码RNA)的上调(图6D,P < 0.05)在PAAD患者中预后较差(P = 0.041)。因此,lncRNA PVT1/hsa-miR-16-5p/CASP6/CASP8调控轴可能是PAAD进展中的关键ceRNA网络(图6E)。
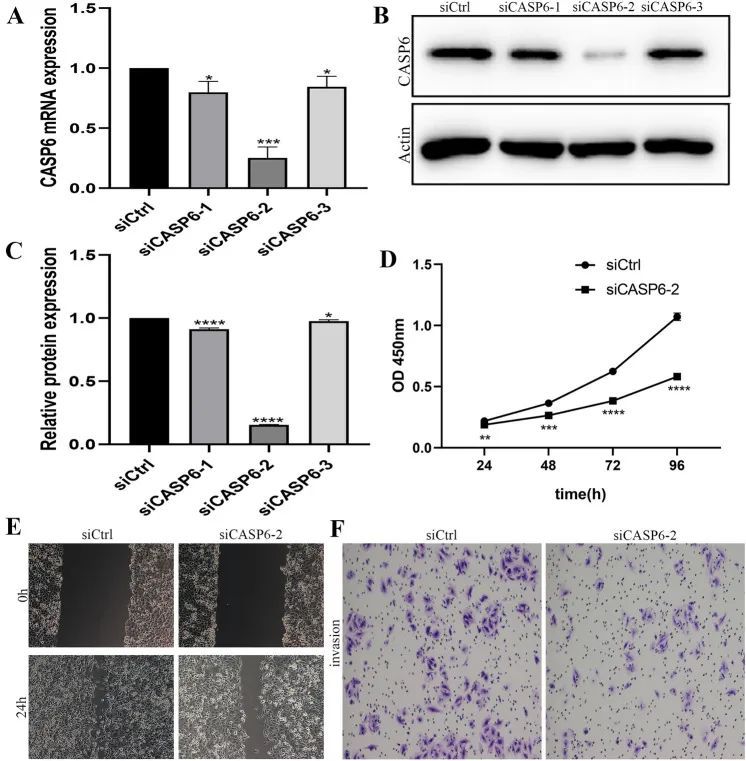
CASP6的击倒抑制了PANC-1细胞的体外增殖、迁移和侵袭
通过qRT-PCR和Western blotting验证了CASP6在PANC-1细胞中的沉默效果,并选择了具有更好沉默效果的siCASP6-2组进行进一步分析(图7A-C)。在图7D中,CASP6的沉默抑制了PANC-1细胞在CCK-8实验中的活性(P < 0.05)。创伤愈合实验表明,CASP6的沉默明显降低了PANC-1细胞的迁移能力(P < 0.05)(图7E)。此外,Transwell实验显示,与对照组相比,siCASP6-2组的侵袭细胞数量显著减少(P < 0.05)(图7F)。
总结
PRGs与预后、TMB、免疫检查点和免疫浸润有关,CASP6可能是一个潜在的生物标志物,在PAAD的发生和进展中起促进作用。体外实验证实了CASP6在PAAD中的致癌基因作用,CASP6抑制阻止了PANC-1细胞的增殖、迁移和侵袭。此外,作者首次确定了PAAD进展中的一个关键ceRNA调控轴lncRNA PVT1/hsa-miR-16-5p/CASP6/CASP8。本研究初步揭示了PAAD进展的潜在生物标志物和分子机制,有助于发现治疗靶点。对这篇文章的思路感兴趣的老师,欢迎咨询!





+springboot)
)
二十六 使用cvlib进行人脸检测、性别检测和目标检测)











