本文采自美国著名科普杂志,Townsendletter,发抗坏血酸口服生物利用中意外的早期反应。本研究提示,口服VC可能达到与静脉VC相同或接近的血液VC水平,而且纯VC比VC钠盐吸收更好。这是前所未料的。-成长博士。
介绍:
重复和廉价的实验使人们怀疑这样一种假设,即只有200毫克的维生素C口服可以吸收。我们用一种新的方法测量了口服后前40分钟内每分钟的维生素C血浆水平。与主流模式相比,我们的结果表明,口腔服用的抗坏血酸(维生素C)可产生与静脉输注相同的血浆浓度快速增加。以前的研究没有在口腔摄入的早期阶段对血液水平进行采样。我们确认,特定的血糖计确实提供了抗坏血(维生素C)浓度的可重复测量。研究人员先前已经证明,在静脉注射维生素C(IV/C)期间和之后,特定血糖仪能够测量高水平的维生素C(1)。我们最初的目的是确认该方法是否充分。然而,我们观察到,仪表对较低的口服量有反应,并发现口腔吸收率最初很高,这可能增加对维生素C的药代动力学的理解,并具有临床和营养影响。
方法:
2012 年,我们观察到雅培实验室 FreeStyle® Lite 葡萄糖计对血浆中的维生素 C 做出定量响应。这与葡萄糖和维生素C的相似性一致。从生物学上讲,这种相似性导致脱氢抗坏血酸(氧化的维生素C)通过Glut被摄入细胞(2-4)。葡萄糖计产品的用户手册中提到了维生素C含量高的潜在"错误"。最初,定量反应是基于维生素C基金会成员的直接观察和报告(5)。
数据采自使用三个雅培 FreeStyle® Lite 葡萄糖计,这些仪表是在 2013 年至 2015 年间在当地购买的。对每个雅培设备进行检查,以确认其对测试溶液中的抗坏血酸浓度有线性和比例的反应,与受试者进行静脉注射维生素C时预计的浓度相当。数据估算采自三个不同的仪表读数交替的结果,即葡萄糖计 A 测量第1 和第4分钟,以此类推。mg/dl 是美国血糖计报告的单位。这些数字不是正确的抗坏血酸浓度,但用于显示血液抗坏血酸的相对变化。在收集数据期间,血浆葡萄糖水平预计约为恒定。这些实验的对象是一位61岁的男性,胰岛素依赖型糖尿病。这些实验在同一个人上同时进行,在睡眠期间禁食至少8小时后,于清晨进行。该病人内源性胰岛素生产的缺乏使任何生理胰岛素对葡萄糖或抗坏血酸水平相关的反应降到最低。
在我们的第一个实验中,我们测量了静脉注射维生素C直接注入血液的相对抗坏血酸水平。根据维生素C静脉输注所需的要求,我们使用了抗坏血酸钠。由于维生素C是抗坏血酸离子,所以我们调整抗坏血酸钠剂量到11.3克,其中含维生素C10克。
实验2测量了相对抗坏血酸水平,而口服维生素C(抗坏血酸)的摄入速率与抗坏血酸钠静脉输液率相同(250毫克/分钟)。同样,测量了抗坏血酸每分钟血浆水平,同样交替使用仪表测试。图2将口服维生素C作为抗坏血酸缓慢引入的血浆反应与第一个实验的数据——抗坏血酸钠IV输液进行了比较。 第二个图中采用了三个仪器的均值。基线IV/C抗坏血酸钠数据为平均值。
实验3测量了单一大剂量10克的抗坏血酸后的相对抗坏血症浓度。10克相当于第一次实验中静脉输注所给予的维生素C。测量值与基线 IV/C 相同的 40 分钟周期中每分钟进行测量。图3将维生素C作为抗坏血酸的单口服剂量的血浆反应与第一个实验的数据——抗坏血酸钠IV/C输液进行了比较。记录了所有三个仪器的数据,以显示抗坏血酸凝血剂的血液水平的快速变化。IV/C基线数据为平均值。
实验4测量了在单一、大剂量、11.3克口服剂量的抗坏血酸钠(含10 克维生素 C)后的相对抗坏血剂浓度。测量是按分钟、交替计数,在基线IV/C的40分钟内进行。
所有实验中施用的维生素C的量是相同的(10克抗坏血酸)。
实验5测量了10克单口服剂量的葡萄糖,以与口服抗坏血酸的进行比较。
结果:
实验1:10克IV/C输液(11.3克抗坏血酸钠)
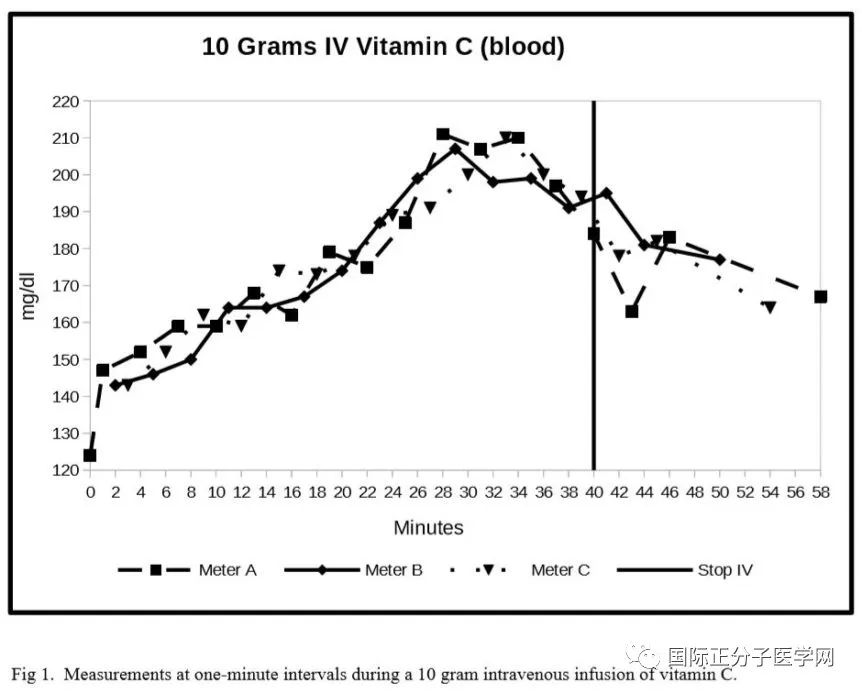
图 1. 抗坏血酸钠 IV/C 输注前40分钟内每分钟VC量数据。
第一个实验测量的是静脉注射维生素C时的"葡萄糖"水平,尽管没有葡萄糖。
图 1 中的图表显示了稳步上升的血液水平,直到静脉注射结束,相对血液水平开始下降。使用三个雅培仪表将随机测量误差降至最低。
我们使用 Microsoft Excel 2007 数据分析包对仪表进行了回归分析,这为在测量进行可视化检查方面的良好协议提供了重要支持。仪表 A-IV 和 B-IV 的多个 R 值为 0.82 (F=30.69;P=5.66×10-5)。使用 A-IV 和 C-IV 时,R 为 0.72(F=14.89;p=1.74×10-3)。对于 B-IV 和 C-IV,R 为 0.91(F=66.58;p=1.09×10-6)。
这些测量的一致性表明,这些仪表测量了维生素C血液水平。然而,这些测量是毫克/dl的葡萄糖,而不是准确的维生素C浓度。
IV袋在第34分钟清空,线排水,针在第40分钟被取出。IV浓度的增加也符合我们的体外测量。IV末期的下降说明了维生素短30分钟的半衰。首先近似,我们采取禁食受试者的血糖水平是恒定的这一时期。
实验2:口服抗坏血酸,其速率与IV相同。
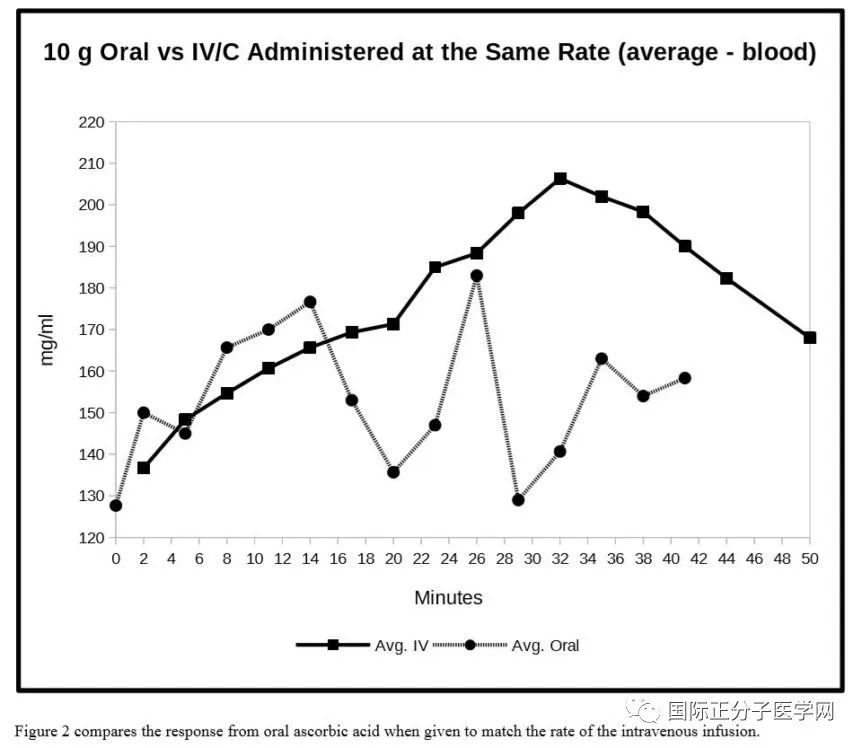
图2比较了口服抗坏血酸与静脉抗坏血酸输液率相匹配时的反应。
第二个实验以与实验1中静脉输注相同的速率(250毫克/分钟)口服维生素C。前15-16分钟(4,000毫克),口服抗坏血酸和静脉注射性抗坏血酸在维生素C血液水平上差别不大。在此时期之后,口服的浓度下降。实验表明,4克口服维生素C作为抗坏血酸进入血液,维生素C直接由静脉引入。事实上,最初的口腔测量似乎比IV/C的测量值稍大,这表明通过胃壁可以有效吸收。
受试者服用的维生素C与输液的速度相同,即每分钟口服250毫克抗坏血酸,每次40分钟。
实验结果表明,前15分钟口服IV/C之间的血水平相当。在此期间后,与静脉注射/C相比,口腔血水平有所下降。吸收率的下降可能反映胃pH的增加,因为抗坏血酸缓冲胃内容物(HCl)。
实验3:单10克抗坏血酸口服剂量与IV相比
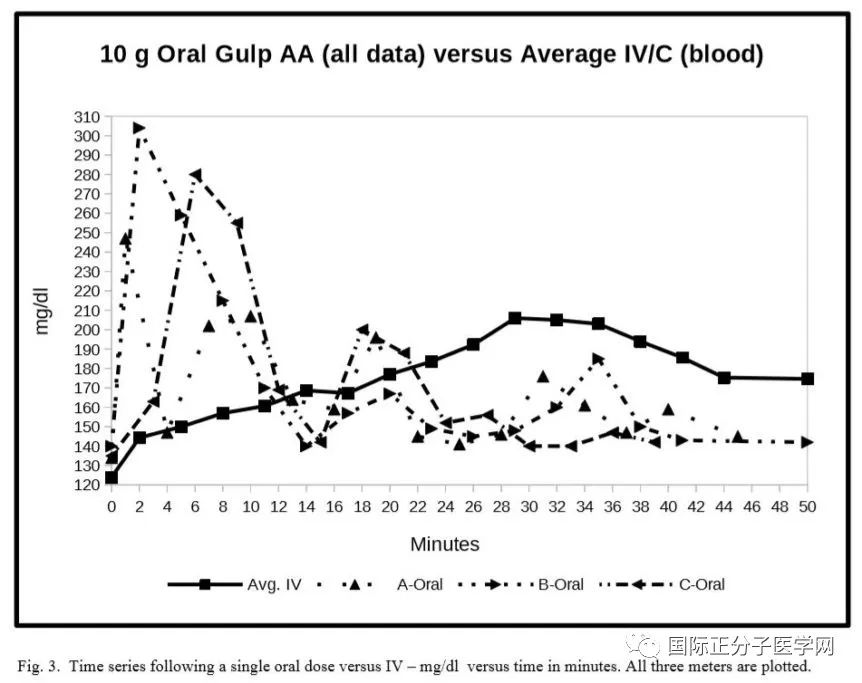
图 3. 单次口服剂量后的时间序列与IV + mg/dl 与分钟时间。记录了所有三个仪器的数据。
第三个实验测量了一次性大剂量(10克)的抗坏血酸口服后维生素C浓度。数据显示,血液水平早在第3分钟就飙升到高于静脉输注的40分钟后的水平。然后逐渐下降至第12分时达到最低。这些完全出乎意料的结果表明,口服抗坏血酸可以产生瞬时高血液水平的维生素C。任何测量周期较长的实验都会错过这些瞬态高水平。需要逐分钟快速测量才能观察这些高值。
在图3中,我们测量了单次口服剂量为10克抗坏血酸后的血液浓度。
出乎意料的是,血抗坏血酸水平早而显著地飙升。最高水平早在第3分钟出现,从3分钟到7分钟略有变化。第15分钟时,第一个峰值已经回落到基线IV/C。这个初始高水平与实验2中表明口服抗坏血酸的快速初始吸收结果一致。
我们调查了快速进入血流是通过口腔或胃中的粘膜进入的。我们发观长时间口含10克维生素C溶液对血液维生素C量没有明显影响。
我们最初的发现是,在单一大剂量的抗坏血酸后的头12分钟,维生素C的血液浓度大大高于静脉输注产生的水平。在最初的几分钟内维生素C很可能是通过胃粘膜进入血液。
实验4:单11.3克抗坏钠口服剂量
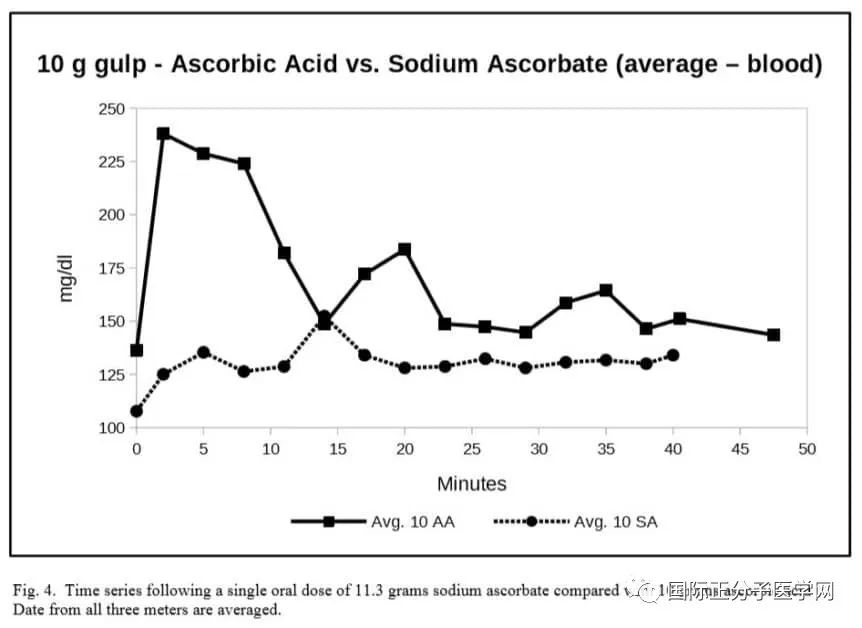
图 4. 时间序列后,单口服剂量为11.3克抗坏血酸钠与10克抗坏血酸相比。采用了所有三个仪器的平均值。
第四个实验测量了单一大剂量(11.3克)的抗坏血酸钠口服后维生素C浓度。在图4中,我们将单次口服11.3克抗坏血酸钠(含10克维生素C)后的血液浓度与实验3的单一10克抗坏血酸数据进行比较。
图4说明了相对维生素C血水平的差异,这取决于维生素是作为抗坏血酸或抗坏血酸钠服用的。数据显示,抗坏血酸钠导致维生素C血量上升较慢。未测到高值瞬态尖峰。
这项口服抗坏血酸钠的实验表明,维生素C的形式可能决定维生素C进入血液的速度。口服抗坏血酸钠后的血液浓度模式与口服抗坏血酸明显不同。抗坏血酸钠浓度较低,也许是因为抗坏血酸钠需要更多的时间吸收到血液中,因为维生素从胃传到肠道。
我们的校准测量表明,血糖仪可能报告相同的抗坏酸钠和抗坏血酸浓度不同。(这些校准是在水中,而不是血液,使血糖表读数困难,容易出错。即使血液水平不能直接比较,进入血液的模式在两种形式的维生素C之间也明显不同。轻度酸性抗坏血酸在血液中具有快速的进入效应,而碱性抗坏血酸钠的进入速度较慢,更像超时释放。
实验5:单10克口服葡萄糖剂量
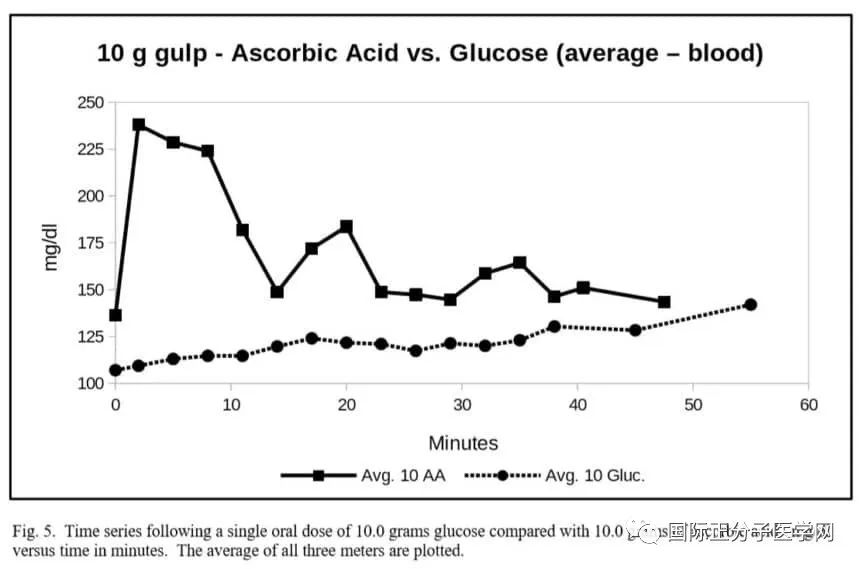
图5. 单次口服剂量为10.0克葡萄糖后的时间序列与10.0克抗坏血酸(mg/dl)相比(AA=Vit C;Gluc=葡萄糖)。采用了所有三个仪器的平均值。
有人可能担心,我们测量的是葡萄糖,而不是抗坏血酸。作为对照,在图5中,我们测量了单次口服剂量为10克葡萄糖后的血液浓度。
图5将实验3中的口服抗坏血酸数据与葡萄糖实验进行了比较。
在图5中,将葡萄糖的血液水平与维生素C抗坏血酸进行比较。测量值对葡萄糖大概是准确的。虽然实际维生素C浓度未知,但进入血液的模式不同。
讨论:
这里报道的维生素C对血液的吸收通常很实用,因为一些血糖仪对血液中的抗坏血酸水平很敏感,可以用来测量维生素C值。虽然血浆葡萄糖大于抗坏血酸水平,但在禁食期间,血葡萄糖水平预计大致保持不变。胰岛素可能会影响实验,因为胰岛素影响维生素C(或葡萄糖)进入细胞。这个糖尿病受试者没有胰岛素分泌,使我们能够排除胰岛素的这种影响。我们先前已经确定仪表对抗坏血酸的反应大于葡萄糖,这大概与测量的氧化还原方面有关。这些逐分钟测量在文献中来说是新的,部分原因是在收集血液和储存血液以进行如此多的测量时遇到实际困难,但可能反映了快速口腔反应的意外性质。
并不是每个品牌或型号的血糖仪都对抗坏血酸敏感,而且这些机制的细节在商业上是敏感的。我们测试到了几个对抗坏血酸浓度没有反应的仪器。FDA可能会认为对维生素C有反应的葡萄糖计是有缺陷。因此,制造商可能被迫升级其仪表,使雅培和其他仪表的未来版本无法测试维生素 C 。 理想情况下,将提供一个低成本的指尖抗坏血(维生素C)表,以便进行精确的测量。新西兰的一家新公司最近宣布,他们正在开发这种仪表。
我们校准了雅培 FreeStyle® Lite 葡萄糖计,针对精确测量的抗坏血酸溶液,这些溶液相当于血液中浓度的 0.5 至 1.5 mg/dl.2 该计对测得的抗坏血剂浓度提供线性比例响应。在这里,我们关心的是血浆相对于基线的快速变化。这些实验比较了口腔和静脉注射的相对血液浓度,以及不同形式的维生素C。
在这份初步报告中,我们显示,在缓慢静脉注射10克维生素C时,三个独立葡萄糖计报告测量的抗坏血酸稳步增加,与血液中维生素C浓度的增加一致。输液结束时,所有三个葡萄糖计的血液水平都随着抗坏血酸30分钟的半衰和抗坏血球的动态流理论而下降(6,7)。
我们的静脉输液数据来自维生素C直接通过静脉引入血液(实验1),提供了大约100%的生物利用度。实验2以相同的速率比较口服和静脉注射维生素C。我们预计,从口服吸收进入血液的维生素C会更少。
比较前15分钟(4000毫克)静脉输液的每分钟读数是前所未有的,并得出同样数量的维生素C进入血液的合理结论。一些先前的研究报告说,在组织饱和之前只能吸收大约250毫克。
在第三个实验中,一次口服10克维生素C。逐分钟测量与缓慢的静脉输注进行比较。令人惊讶的发现是,在最初的几分钟内,10克抗坏血酸的快速口服吸收产生高于低剂量IV/C的血液水平。
抗坏血酸的测量结果出乎意料。基线和口服抗坏血酸之间的血液浓度以相同的速率是可比的,并且表现出相当于4000毫克的生物利用度。大量一次性剂量的生物利用量产生的VC血液水平高于相同量的静脉输注。
在第四个实验中,一次口服了11.3克维生素C钠。这些测量结果与口服抗坏血酸进行了比较。另一个(意料之外的)发现是不同形式的维生素C的吸收率之间的意外差异。
虽然抗坏血酸反应出乎意料,但它与已知的弱酸药代动力学一致。抗坏血酸等弱酸在胃的低pH位变得更容易脂溶性时处于相对非极性状态。弱酸通常迅速从胃吸收。然而,如果胃酸减少,弱酸脱接和极性抑制跨细胞膜的转移。抗坏血酸会缓冲胃的pH(从pH +1到pH+4),并抑制自身的吸收。抗坏血酸钠将是一种更有效的缓冲剂,这可以解释为什么没有观察到最初的吸收尖峰。
对这些案例研究数据的一个反对意见是本初步研究中的个体变异。这种保留是被接受的,并且对于案例研究是常见的,尽管如此,案例研究可以传达有趣的观测数据。测量是直接的,使用的是已成熟的技术(1)。这一现象在人口中有多频繁,仍有待确定。此外,如果观察到的结果能复制,那么口服VC可能为目前正在癌症中临床试验的抗坏血症IV施用提供替代方案。根据这一解释,我们观察到,虽然抗坏血酸可以迅速吸收到血液中,但抗坏血酸钠提高血液水平的速度较慢。
维生素C血液水平必须在30至40分钟内反复测量,以获得维生素C进入血液的准确读数。Cathcart(卡斯卡特)描述了生病和有压力的人可以忍受非常高的口服维生素C量(22)。Cathcart肠耐受量,有时每天高达200克,如果血浆饱和在250毫克,就很难与目前的模式调和。Cathcart还报告说,他只能获得"临床抗坏血剂效应"口服抗坏血酸,而不是抗坏血酸盐。我们可以推测,病人胃酸度增加至少可以部分解释卡斯卡特的观察结果。
这里介绍的抗坏血酸的快速早期吸收和利用,以前还不得而知,可能有助于解释Cathcart报道的内容。
感谢,
史蒂文·希基博士(Steven Hickey,他也是ISOM MNS理事),他的建议和忠告对本文来说是无价的。
托马斯·黑塞林克,医学博士,测量了抗坏血药,并监督了抗坏血酸钠IV/C。
论坛成员约翰·温,谁创造了最初的图表。
维生素C基金会的工作人员杰里诺林,谁更新了图表。
维生素C基金会论坛成员的反馈。
References
Ma, Y, et al. A Convenient Method for Measuring Blood Ascorbate Concentrations in Patients Receiving High-Dose Intravenous Ascorbate. J American College of Nutrition. 2013;32(3):187–193.
Bürzle M, Hediger MA. Functional and physiological role of vitamin C transporters. Curr Top Membr, 2012;70:357-75.
Corti A, Casini AF, Pompella A. Cellular pathways for transport and efflux of ascorbate and dehydroascorbate. Archives of Biochemistry and Biophysics. 2010;500(2):107–115.
Szarka A, Lőrincz T. Cellular and intracellular transport of vitamin C. The physiologic aspects. Orv Heti. 2013;154(42):1651-6.
Fonorow O. Bioavailability of Vitamin C. June 15, 2015. Retrieved from http://vitaminc.foundation/forum/viewtopic.php?f=3&t=11944
Hickey S, Roberts H. Ascorbate: The science of vitamin C. Morrisville, NC; Lulu:2004.
Hickey S, Roberts H. (2005). Ridiculous Dietary Allowance. Lulu.com.
Levine M, Conry-Cantilena C, Wang Y. Vitamin C pharmacokinetics in healthy volunteers: evidence for a recommended dietary allowance. Proc Natl Acad Sci. 1996;93(8):3704–3709.
Levine M, Padayatty SJ, Espey MG. Vitamin C: a concentration-function approach yields pharmacology and therapeutic discoveries. Adv Nutr. 2011;2:78–88.
Chen P, et al. Anti-cancer effect of pharmacologic ascorbate and its interaction with supplementary parenteral glutathione in preclinical cancer models. Free Radical Biology and Medicine. 2011;51(3):681–687.
Monti DA, et al. Phase I Evaluation of Intravenous Ascorbic Acid in Combination with Gemcitabine and Erlotinib in Patients with Metastatic Pancreatic Cancer. PLoS ONE. 2012;7(1): e29794.
Wang G, Yin T, Wang Y. In vitro and in vivo assessment of high-dose vitamin C against murine tumors. Exp Ther Med. 2016;12:3058–3062.
Leekha A, et al. Vitamin C in synergism with cisplatin induces cell death in cervical cancer cells through altered redox cycling and p53 upregulation. J Cancer Res Clin Oncol. 2016; 142(12):2503-2514.
Baek MW, et al. Ascorbic Acid Induces Necrosis in Human Laryngeal Squamous Cell Carcinoma via ROS, PKC, and Calcium Signaling. J Cell Physiol, 2017;232(2):417-425.
Aguilera O, et al. Vitamin C uncouples the Warburg metabolic switch in KRAS mutant colon cancer. Oncotarget. 2016;7(30): 47954–47965.
Frajese GV, et al. Potassium increases the antitumor effects of ascorbic acid in breast cancer cell lines in vitro. Oncology Letters. 2016; 11(6):4224–4234.
Campbell EJ, et al. Pharmacokinetic and anti-cancer properties of high dose ascorbate in solid tumours of ascorbate-dependent mice. Free Radic Biol Med. 2016;99:451–62.
Jung S-A, et al. L-Ascorbic acid can abrogate SVCT2-dependent cetuximab resistance mediated by mutant KRAS in human colon cancer cells. Free Radic Biol Med. 2016;95:200–8.
Chung MK, et al.Randomized Trial of Vitamin C/E Complex for Prevention of Radiation-Induced Xerostomia in Patients with Head and Neck Cancer. Otolaryngol Head Neck Surg. 2016;155(3):423-30.
Zhao F, et al. Synergistic Apoptotic Effect of D-Fraction From Grifola frondosa and Vitamin C on Hepatocellular Carcinoma SMMC-7721 Cells. Integr Cancer Ther. 2017;16(2):205-214.
Parrow NL, Leshin JA, Levine M. Parenteral Ascorbate As a Cancer Therapeutic: A Reassessment Based on Pharmacokinetics. Antioxidants & Redox Signaling. 2013;19(17), 2141–2156.
Cathcart RF. Vitamin, C.; titrating to bowel tolerance, anascorbemia, and acute induced scurvy. Med Hypotheses. 1981;7:1359–1376.






优化 查询 速度)






)
)




