今天给同学们分享一篇生信文章“Landscape analysis of m6A modification regulators related biological functions and immune characteristics in myasthenia gravis”,这篇文章发表在J Transl Med期刊上,影响因子为7.4。

结果解读:
MG相关m6A修饰调控因子的鉴定
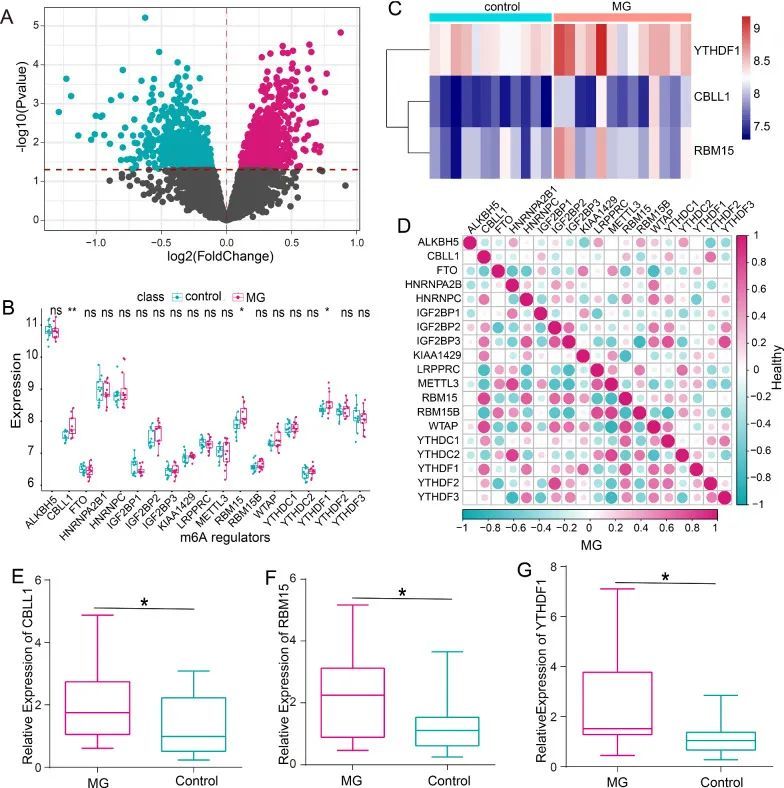
在这项研究中,作者比较了MG样本和健康样本之间的所有基因表达状态,并在火山图(图1A)中标识和显示了差异表达基因(DEGs)。作者手动获取了23个m6A RNA修饰调节因子,但只有19个调节因子在CD14单核细胞中表达(图1B)。其中,作者观察到CBLL1、RBM15和YTHDF1在MG样本中的表达高于健康样本(P < 0.05)(图1C)。此外,在ALKBH5、FTO、HNRNPA2B1、HNRNPC、IGF2BP1、IGF2BP2、IGF2BP3、KIAA1429、LRPPRC、METTL3、RBM15B、WTAP、YTHDC1、YTHDC2、YTHDF2和YTHDF3的表达水平方面,MG样本和健康样本之间没有明显差异。为了评估m6A调节因子在MG发展中的关键作用,作者分别分析了MG样本和健康样本中它们之间的相关性。结果表明,m6A调节因子之间的相关性在MG和健康样本之间发生了显著变化(图1D)。有趣的是,CBLL1、RBM15和YTHDF1之间的相关性在MG样本中比健康样本更强。与此同时,作者收集了MG患者的PBMCs,以检测CBLL1、RBM15和YTHDF1的表达水平。RT-PCR的结果显示,与健康对照组相比,MG患者中CBLL1、RBM15和YTHDF1的表达上调(图1E-G)。
MG相关修饰调节因子的靶基因潜在功能
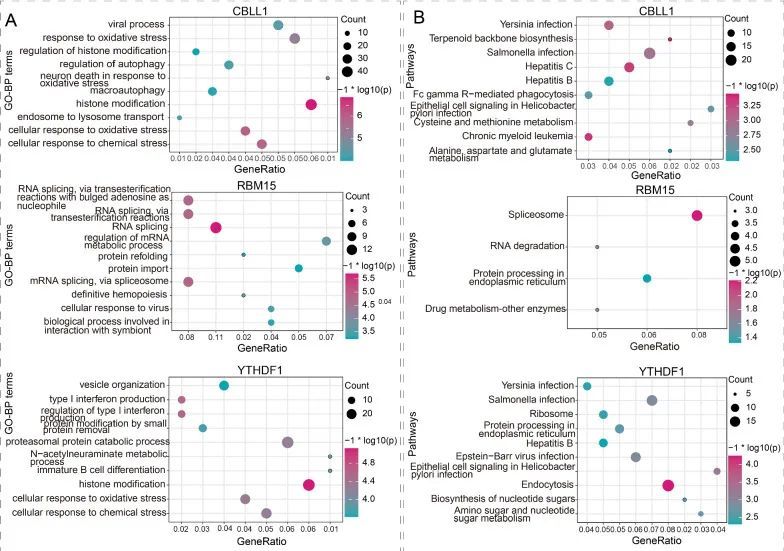
为了探索m6A调控因子在MG中的潜在功能,进行了一系列的生物信息学分析。共表达分析的结果表明,CBLL1表达与2381个基因显著相关,RBM15和YTHDF1的表达水平与2219个和1028个基因有显著的共表达关系。此外,CBLL1、RBM15和YTHDF1可能通过m6A2Target数据库修饰的基因。最终,在MG样本中,分别有819个、138个和531个基因通过m6A RNA修饰被CBLL1、RBM15和YTHDF1分别调控(|r|> 0.5且P < 0.05)。进一步,根据CBLL1、RBM15和YTHDF1调控的基因进行了GO和KEGG富集分析。结果显示,CBLL1、RBM15和YTHDF1分别显著富集了565个、189个和405个GO-BP术语和40个、4个和29个通路。研究结果显示,CBLL1主要参与组蛋白修饰和应对氧化应激相关的GO-BP术语,而RBM15与RNA剪接相关的GO-BP术语有关,YTHDF1与组蛋白修饰和I型干扰素产生相关的GO-BP术语有关(图2A)。KEGG结果表明,CBLL1与慢性髓性白血病、丙型肝炎、半胱氨酸和甲硫氨酸代谢等相关,而RBM15与剪接体通路相关,YTHDF1与内吞作用通路相关(图2B)。
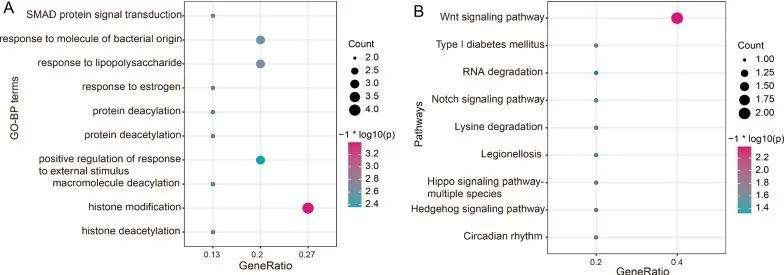
根据CBLL1、RBM15和YTHDF1共同修饰的基因,作者还预测了这三个m6A调控因子的潜在功能。作者观察到它们主要参与了组蛋白修饰(图3A)和Wnt信号通路(图3B)。
m6A修饰调节因子与MG的免疫特征之间的相关性
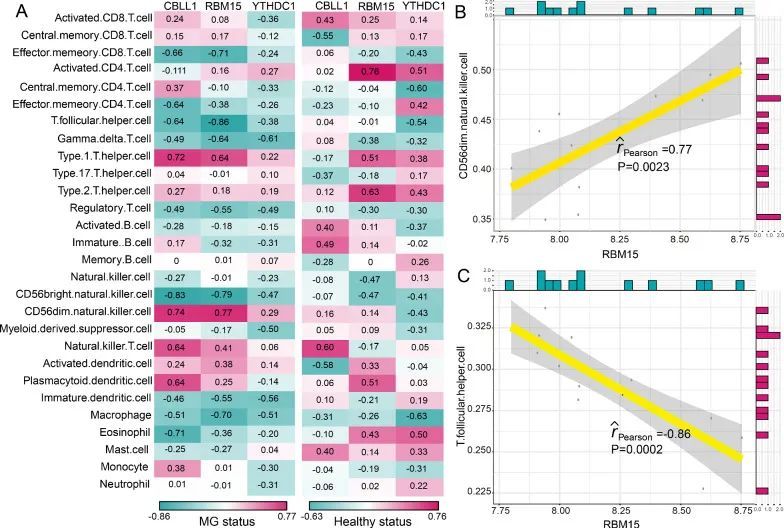
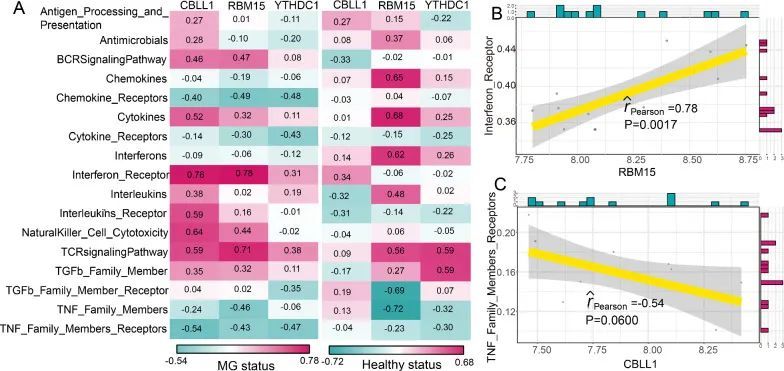
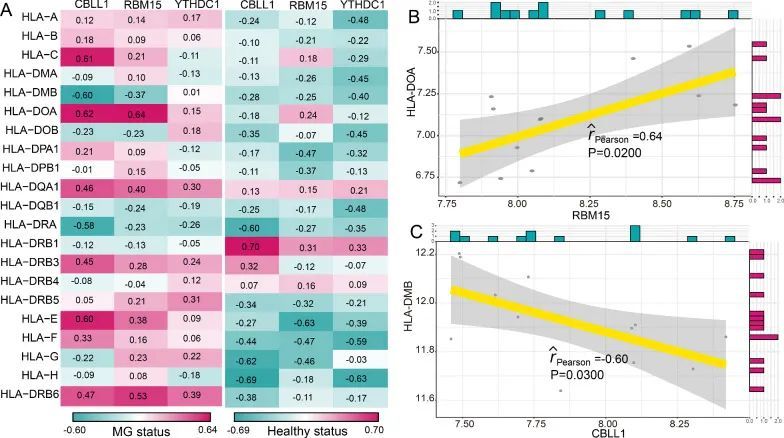
众所周知,重症肌无力的发病机制与免疫密切相关。因此,作者根据一项先前的研究 [21],调查了m6A修饰调节因子与免疫特征之间的关系,包括免疫细胞亚群、免疫反应途径和HLA基因表达。作者发现,在健康状态和重症肌无力状态下,m6A调节因子与免疫细胞亚群之间的相关性发生了变化(图4A)。最正相关的m6A调节因子-免疫细胞对是RBM15-CD56dim自然杀伤细胞,这意味着在重症肌无力中发现了RBM15的表达增加和CD56dim自然杀伤细胞得分增高(图4B)。而最负相关的对是RBM15-T辅助滤泡细胞,表明在重症肌无力中RBM15的表达增加,T辅助滤泡细胞得分降低(图4C)。类似地,从健康状态到重症肌无力患者,免疫反应途径与m6A调节因子之间的相关性也发生了变化(图5A)。RBM15-干扰素受体是最正相关的对,CBLL1-TNF家族成员受体是最负相关的对(图5B和5C)。然而,CBLL1和TNF家族成员受体之间的相关性并不显著(P = 0.06)。结果表明,RBM15可能在干扰素受体的免疫反应途径中发挥关键重要作用。至于HLA基因和m6A调节因子的相关性,在健康和MG样本之间发生了显著变化(图6A)。许多m6A调节因子-HLA基因对之间的负相关变为正相关,或者正相关变为负相关。其中最正相关的m6A调节因子-HLA对是RBM15-HLA-DOA(图6B),最负相关的是CBLL1-HLA-DMB(图6C)。
MG中的不同m6A RNA甲基化修饰模式
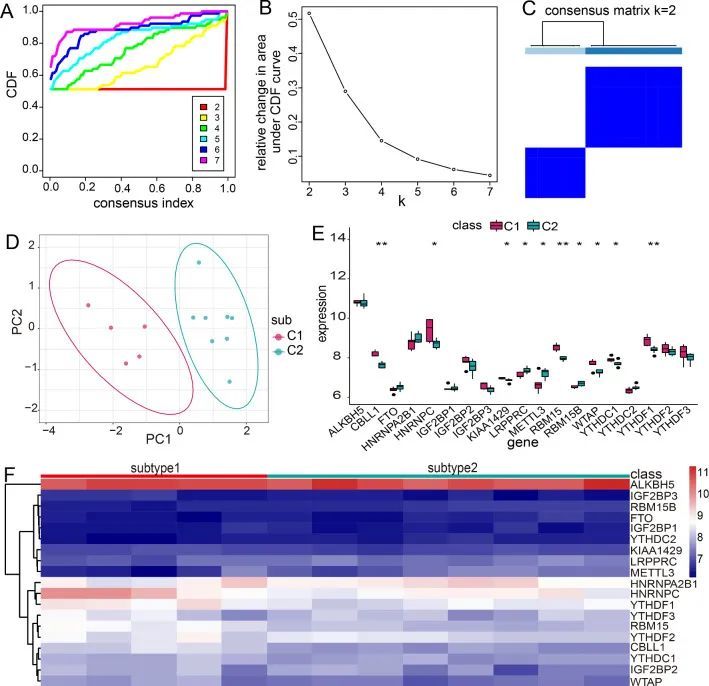
m6A RNA甲基化可以通过调节RNA稳定性、RNA结构和选择性剪接来影响基因表达[22, 23]。因此,作者使用Consensus Cluster Plus R软件包对MG中的异常m6A调节因子进行了共识聚类。结果显示,13个MG样本被聚类为两个亚型,包括亚型1(n = 5)和亚型2(n = 8)(图7A-C)。进一步,对这两个亚型进行PCA分析发现,两种修饰模式之间的转录组表达存在显著差异(图7D)。为了探索19个m6A RNA甲基化调节因子与两个亚型之间的关系,作者比较了两种修饰模式中所有m6A调节因子的表达水平(图7E,F)。作者发现CBLL1、HNRNPC、KIAA1429、RBM15、WTAP、YTHDC1和YTHDF1在亚型1中大多数上调,LRPPRC、METTL3和RBM15B在亚型2中上调。
两种不同的m6A修饰模式中的免疫特征
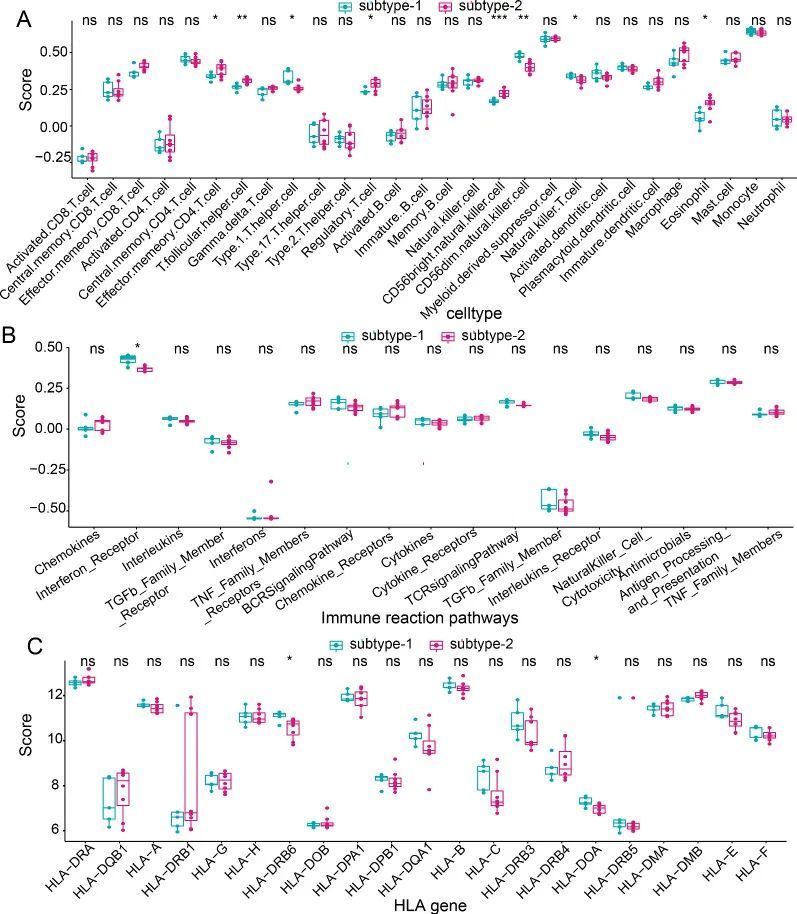
为了描绘两种不同的m6A修饰模式的免疫特征,作者比较了免疫细胞亚群的表达状态、免疫反应通路和HLA基因的表达情况。如预期的那样,两个亚型之间观察到了不同的免疫特征。例如,在亚型1中富集了更高水平的γδT细胞、CD56明亮型自然杀伤细胞和髓系抑制细胞,而亚型2中富集了更高水平的中央记忆CD4 T细胞、效应记忆CD4 T细胞、2型辅助T细胞、自然杀伤细胞和巨噬细胞(图8A)。至于免疫反应通路和HLA基因,两种修饰模式之间只有轻微的差异。只观察到亚型1中更活跃的干扰素受体(图8B)和HLA-DRB6和HLA-DOA的更高表达水平(图8C)。
鉴定与两种m6A修饰模式相关的生物功能和模块
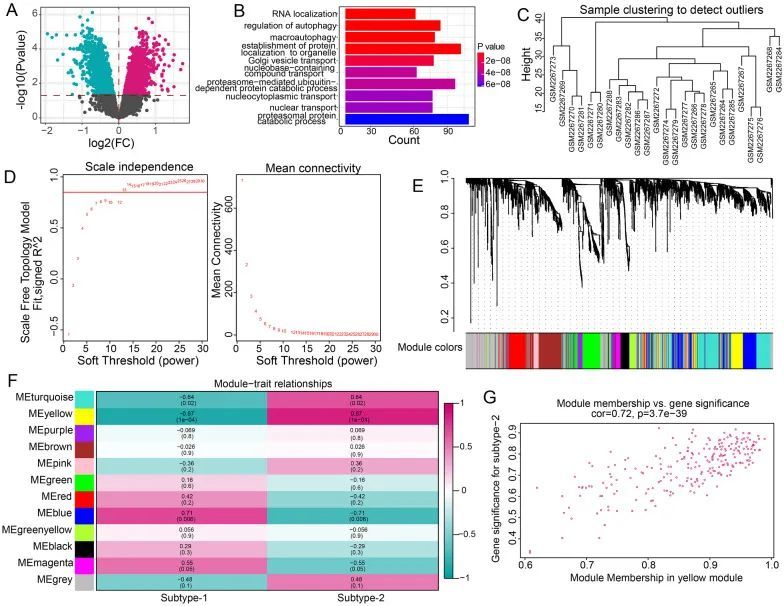
为了进一步了解两种m6A修饰模式的潜在生物功能,作者确定了3029个在两种m6A修饰模式之间差异表达的基因(图9A)。然后,对上述基因进行GO-BP富集分析,结果显示主要富集的GO-BP术语包括RNA定位、自噬调节和巨噬细胞自噬等(图9B)。最后,构建了一个综合基因景观,并使用WGCNA鉴定了基因-基因模块(图9C-E)。作者获得了12个基因模块,然后分析了两种m6A修饰模式与模块之间的关系(图9F)。作者发现黄色模块与亚型2呈最强正相关,黄色模块中的基因与亚型2密切相关(图9G)。
总结
总之,作者首次研究了MG中m6A调控因子的表达特征和生物学功能,以及与MG相关的m6A调控因子与免疫特征之间的关系。作者的结果暗示m6A调控因子可能在MG的发病机制中起重要作用。作者的研究结果将为进一步设计实验研究m6A修饰在MG中的作用提供理论基础,并为研究其他疾病,特别是自身免疫性疾病的发病机制开辟新的方向。然而,作者的研究也存在一些限制。首先,这项工作基于生物信息学分析,许多发现在理论上是有效的,但其准确性仍需通过设计湿实验进行验证。其次,本研究中包含的MG样本较少,需要扩大样本规模进行进一步研究。尽管如此,作者的研究确实揭示了m6A修饰对MG分子机制的显著影响,并为理解MG潜在发病机制提供了新的视角。


)

)


)
![[论文阅读]Multimodal Virtual Point 3D Detection](http://pic.xiahunao.cn/[论文阅读]Multimodal Virtual Point 3D Detection)







| 使用AutoGen、LangChian、RAG以及函数调用构建超级对话系统)


