今天给同学们分享一篇生信文章“Identification of lactylation related model to predict prognostic, tumor infiltrating immunocytes and response of immunotherapy in gastric cancer”,这篇文章发表在Front Immunol期刊上,影响因子为7.3。

结果解读:
乳酸化相关基因在GC中的表达
通过GSEA数据库,作者确定了在GC组织中显著上调的四个与乳酰化相关的通路(图2A)。作者推测这四个与乳酰化相关的通路与GC的发生和演化直接相关。
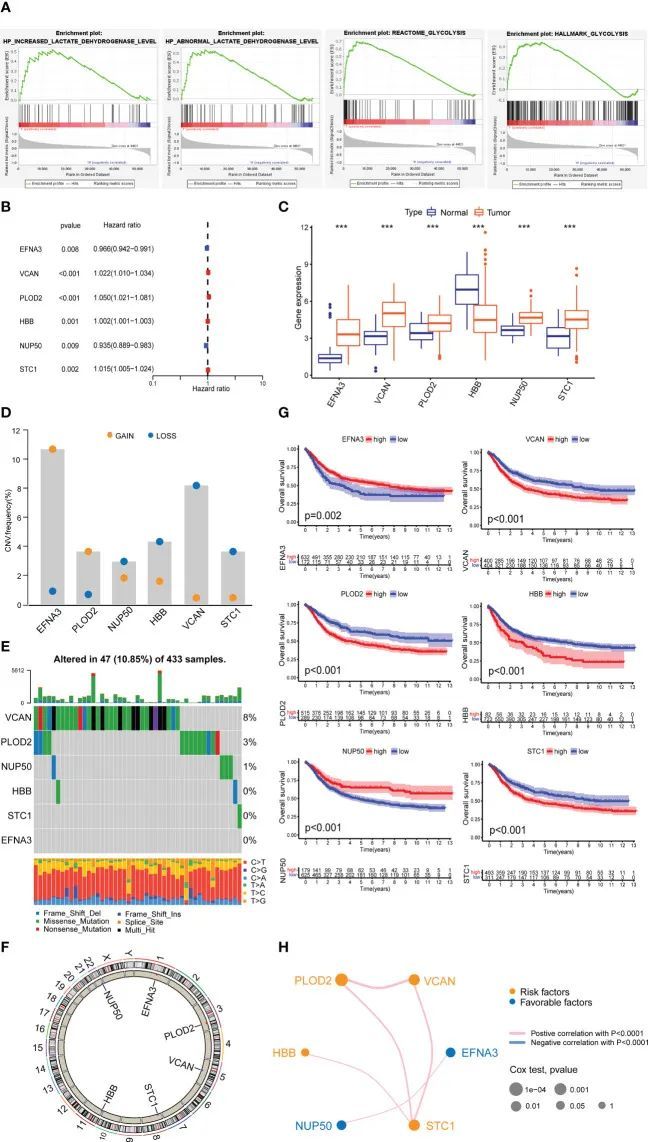
聚类分析
作者使用乳酰化相关基因的聚类分析将所有GC样本分为两个亚型(图3A-C)。生存分析显示了两个GC亚型之间的显著差异(图3D)。与亚型1相比,亚型2的生存率要低得多。作者使用ssGSEA方法确定了两个GC亚型中23种不同免疫细胞类型的比例。在两个GC亚型之间,有18种免疫细胞类型存在显著差异(图3E)。作者还将GC样本的临床病理特征和乳酰化基因绘制成热图(图3F)。使用GSVA算法,作者将两个GC亚型富集的GO和KEGG通路绘制成热图。亚型2中富集的GO通路主要集中在血管生成和上皮细胞增殖(图3G),例如ENDOTHELIAL_CELL_PROLIFERATION和REGULATION_OF_VASCULATURE_DEVELOPMENT。亚型2中富集的KEGG通路主要集中在转移相关通路(图3H),例如FOCAL_ADHENSION和TGF_BETA_SIGNALING_PATHWAY。
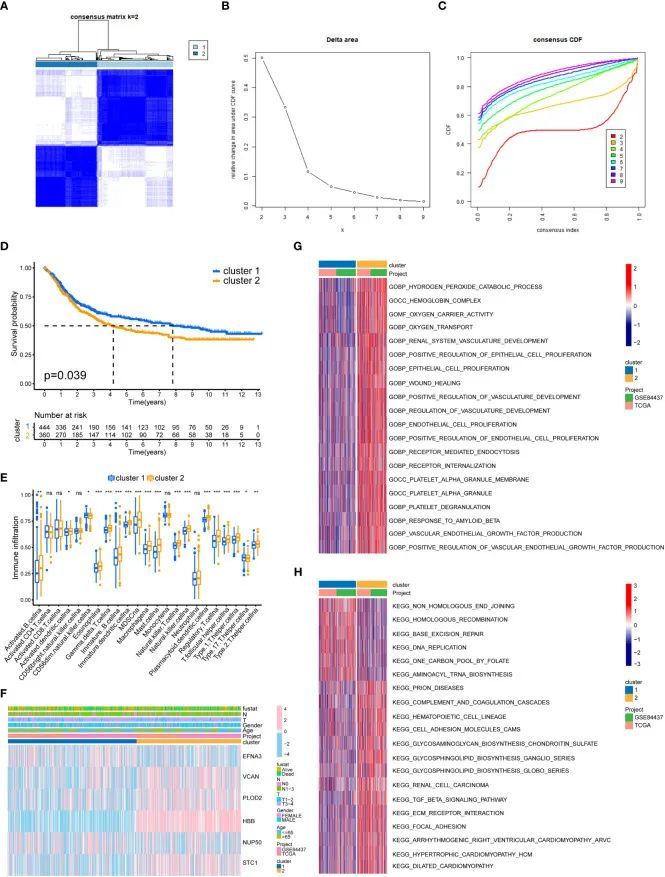
构建乳酸化评分模型
对所有GC样本进行的PCA分析结果(图4A)显示,两个GC亚型之间的交集很小,并且每个GC亚型内的成分之间存在良好的相关性。图4B显示,亚型2的乳酰化评分明显高于亚型1。高乳酰化评分组的生存率明显低于低乳酰化评分组(图4C),表明乳酰化评分越高,预后越差。在两组中还进行了TMB分析,结果显示两者之间存在负相关(图4D、E)。作者还构建了GC亚型、乳酰化评分和患者生存的桑基图。图4F显示,亚型2的GC与高乳酰化评分之间存在高度相关性,而亚型1与低乳酰化评分相关。低乳酰化评分组中大部分样本处于生存状态,而高乳酰化评分组中大多数患者死亡。作者创建了一个瀑布图来比较两组中单基因突变的患病率(图4G、H)。低乳酸化评分组中单基因突变的患病率高于高乳酸化评分组。图4I显示高TMB组的生存率明显高于低TMB组。此外,作者还对肿瘤突变负荷组和乳酸化评分组进行了联合分析(图4J)。结果显示统计学差异,表明胃癌患者的预后受到TMB和乳酸化评分的影响。
不同乳酸化评分组的预后和临床病理特征
此外,作者还研究了患者的临床病理特征以及乳酸化评分。年龄、性别和T分期在两个乳酸化评分组之间没有显著差异,如图4K所示。此外,恶性预后、高肿瘤分级和淋巴结转移都与高乳酸化评分密切相关。这表明从临床病理特征的角度来看,高乳酸化评分往往暗示着更高的恶性程度。作者还构建了诊断图(图4L),通过对临床病理特征和乳酸化评分进行统计评分,可以对患者的风险进行分类,并预测患者的生存情况。结果显示,如果患者的总分达到448分,患者的1年、2年和3年死亡率分别为28%、53.6%和66%。作者还绘制了诊断图的ROC曲线(图4M)。1年、2年和3年的AUC面积均大于0.65。
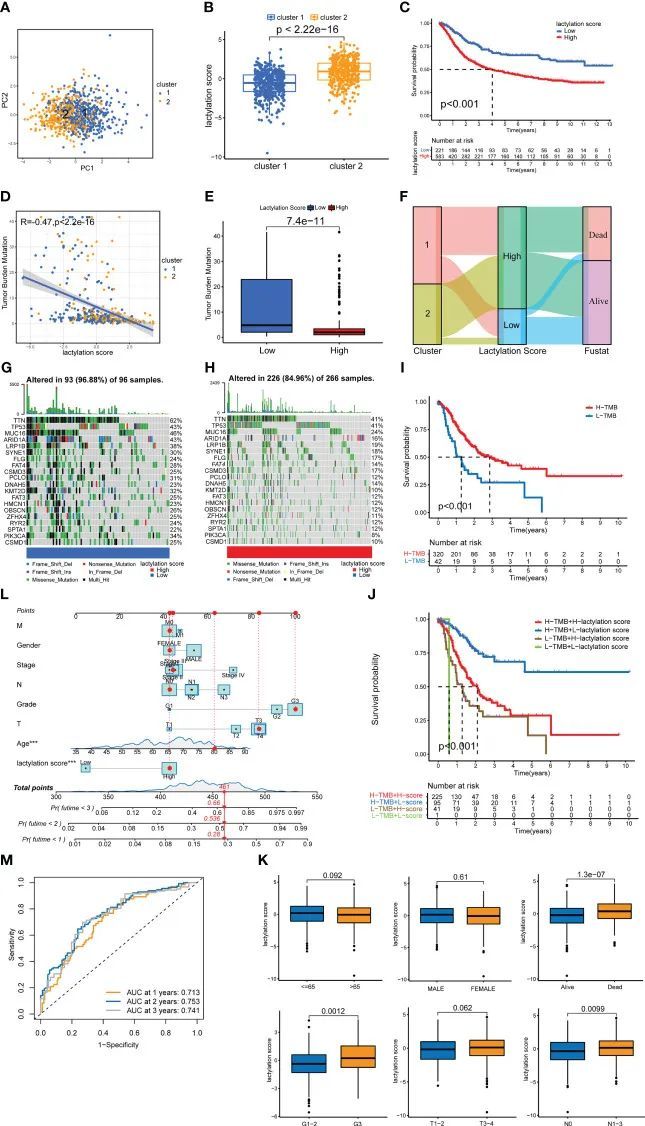
免疫细胞浸润声明和功能富集分析
根据ESTIMATE算法,高乳酸化评分组的基质和免疫得分在统计上显著高于低乳酸化评分组。这表明高乳酸化评分组中基质细胞和免疫细胞浸润的比例更大(25)。高乳酸化评分组的ESTIMATE得分明显高于低乳酸化评分组,表明乳酸化评分水平与肿瘤纯度呈负相关(图5C)。通过结合各种免疫细胞分析方法,作者分析了乳酸化评分与免疫细胞浸润之间的相关性(图5A)。研究结果显示,巨噬细胞和M2型巨噬细胞浸润程度与乳酸化评分呈正相关(图5B)。KEGG和Hallmark富集分析显示,乳酸化模型与多个致癌通路密切相关(包括WNT、TGF_BETA、MTOR、P53_SIGNALING)(图5D、E)。同时,Hallmark富集分析显示,乳酰化模型与HALLMARK_EPITHELIAL_MESENCHYMAL_TRANSITION和HALLMARK_ANGIOGENESIS密切相关(图5E)。这表明,乳酰化得分越高,胃癌的增殖、转移和侵袭能力越强。
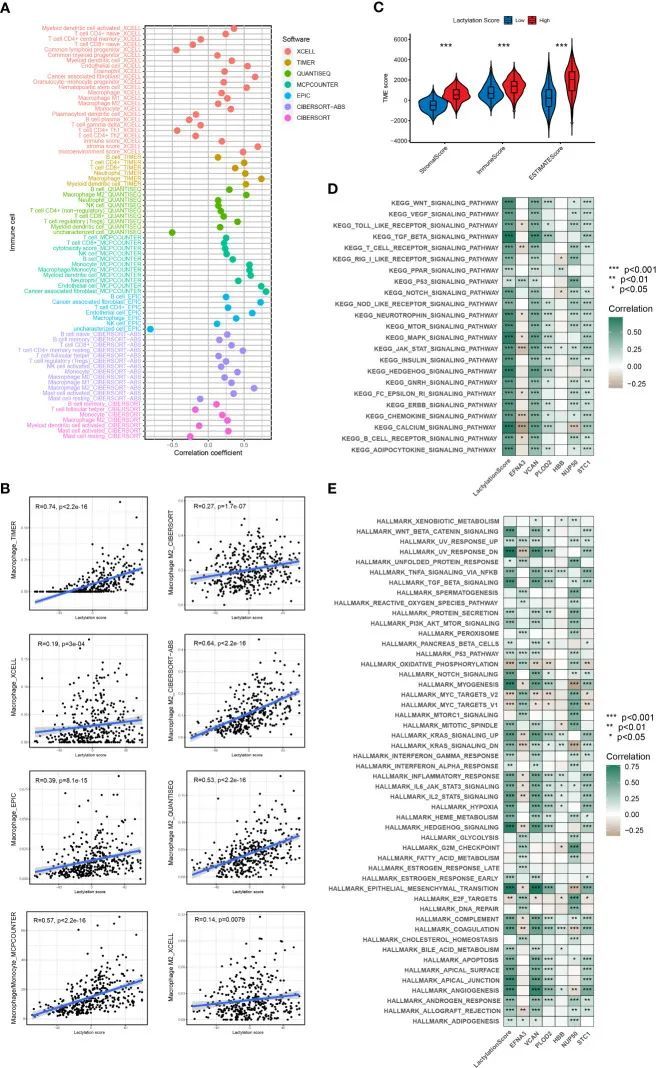
免疫疗法反应和免疫逃避
作者的研究还发现,乳酸化评分与免疫检查点治疗的疗效相关。图6A显示,乳酸化评分较低的患者对ICIs(ctla4_pos_pd1_neg)具有更高的响应率(p<0.05)。此外,高乳酸化评分组更容易获得ctla4免疫疗法的耐药性。作者还预测了高乳酸化评分组和低乳酸化评分组的药物敏感性,并发现大多数药物在低乳酸化评分组中表现出更高的敏感性,而只有两种药物(吉非替尼和二甲双胍)在高乳酸化评分组中表现出更高的敏感性。免疫逃避可能导致对免疫疗法的耐药性。一种名为TIDE评分的算法用于确定不同肿瘤类型中T细胞功能障碍和排斥情况。这些评分可以用于预测免疫检查点治疗对肿瘤患者的影响,并与免疫逃避特征一致(26)。图6B显示,高乳酸化评分组的TIDE、排斥和功能障碍评分均显著高于低乳酸化评分组。进一步导致免疫逃避和免疫治疗抵抗的是高乳酰化评分组对免疫功能障碍和免疫排斥的增加敏感性。作者还观察了乳酰化评分和微卫星的不稳定性。低乳酰化评分组显示出增加的微卫星不稳定性,如图6C、D所示。
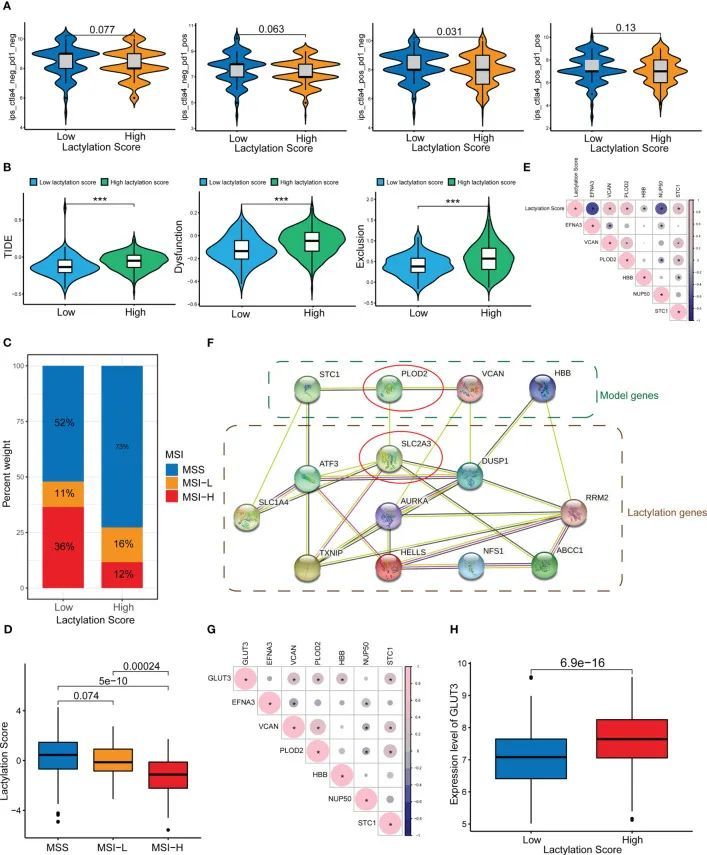
乳酸化相关基因在GC中的表达
图6E显示了乳酰化评分与乳酰化基因之间的相关性。作者构建了一个乳酰化相关基因/蛋白质和文献报道的乳酰化靶基因的PPI网络(图6F)。在PPI网络的中心,PLOD2和SLC2A3(GLUT3)具有更高的优先级。此外,PLOD2和GLUT3之间存在相互作用。作者推测PLOD2可能通过GLUT3影响GC的乳酰化水平,从而导致GC的发展和进展。图6G显示了GLUT3和乳酰化基因之间的相关性,可以看出GLUT3和PLOD2之间存在强烈的连接。此外,高乳酰化评分组的GLUT3表达水平明显高于低乳酰化评分组(图6H)。
PLOD2、GLUT3和GC中的乳酰化之间的关系
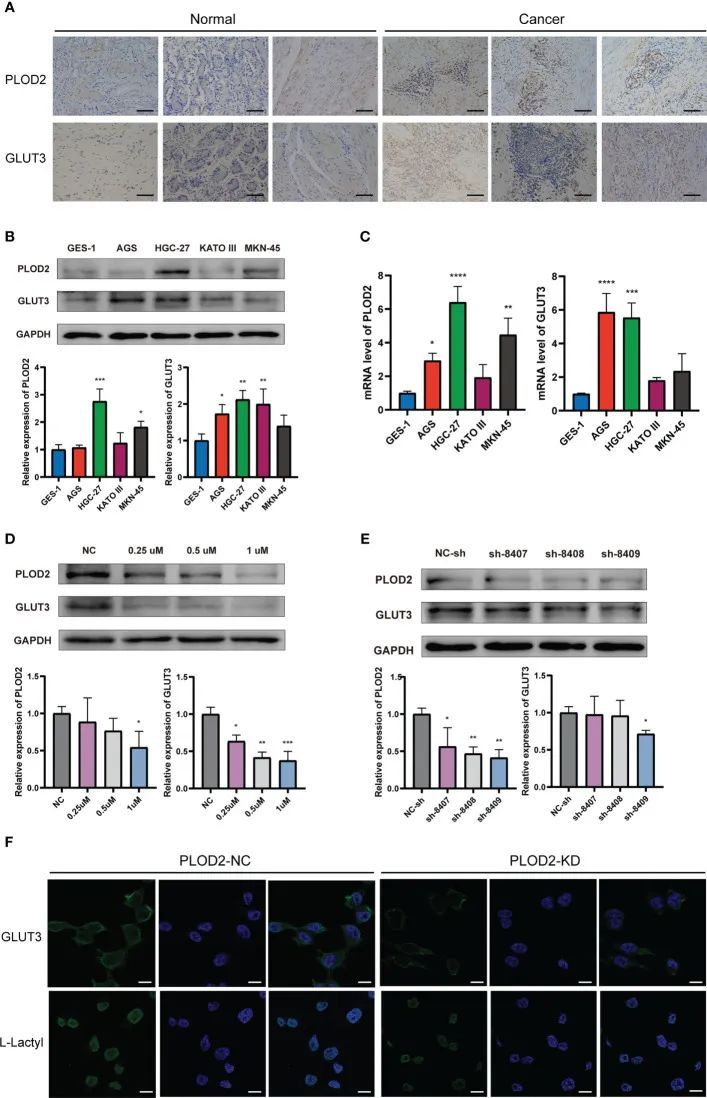
作者在正常胃组织和GC样本中进行了免疫组化实验(图7A)。图中显示,GC样本中PLOD2和GLUT3的表达程度均明显高于正常胃样本。图7B、C显示,GC细胞系中PLOD2和GLUT3的表达较GES-1细胞更高。在HGC-27和MKN-45中,PLOD2的表达显著高,而GLUT3的表达在HGC-27中最高。
PLOD2在GC细胞中的功能表型
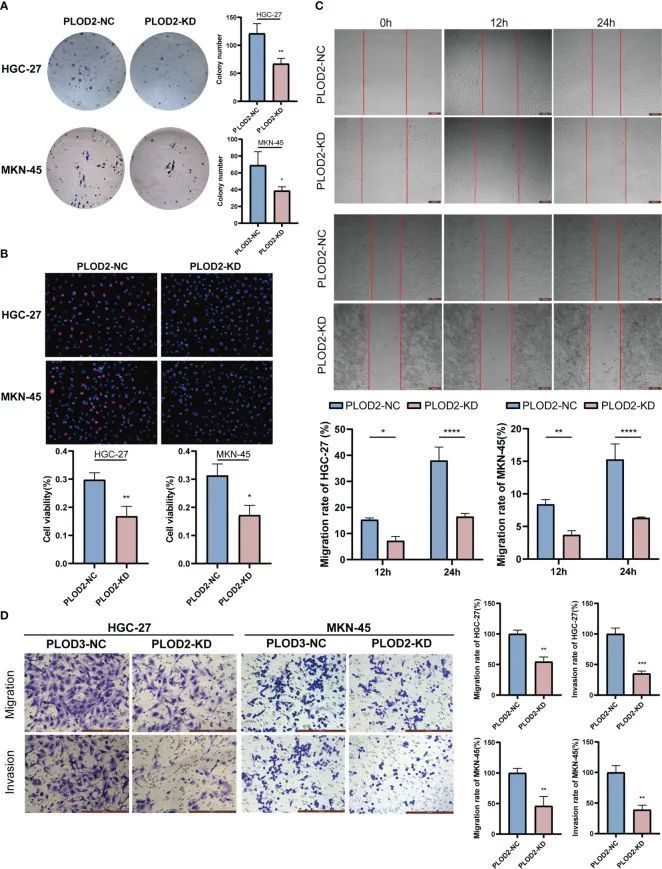
在击倒PLOD2后,作者检查了GC细胞的功能表型变化。图8A显示,PLOD2-KD中的细胞克隆数量明显少于PLOD2-NC。EdU实验还显示,PLOD2-KD组的细胞存活能力显著降低(图8B)。在划痕实验中,PLOD2-KD组的细胞划痕明显更宽(图8C)。同样,Transwell实验表明,PLOD2基因敲除阻止了HGC-27和MKN45细胞的迁移和侵袭(图8D)。
总结
总之,乳酸化评分可能有助于GC的分子分类,因为它有助于识别不同的免疫浸润模式和基因组不稳定性。乳酸化评分也可作为评估患者对ICI治疗反应的方法。











)


![[Stream]自定义的Collect筛选](http://pic.xiahunao.cn/[Stream]自定义的Collect筛选)

Oracle 数据泵分析table_exists_action参数)


