今天给同学们分享一篇生信文章“The pathogenesis of DLD-mediated cuproptosis induced spinal cord injury and its regulation on immune microenvironment”,这篇文章发表在Front Cell Neurosci期刊上,影响因子为5.3。

结果解读:
基因芯片质量控制
该研究的流程图可在图1中找到。
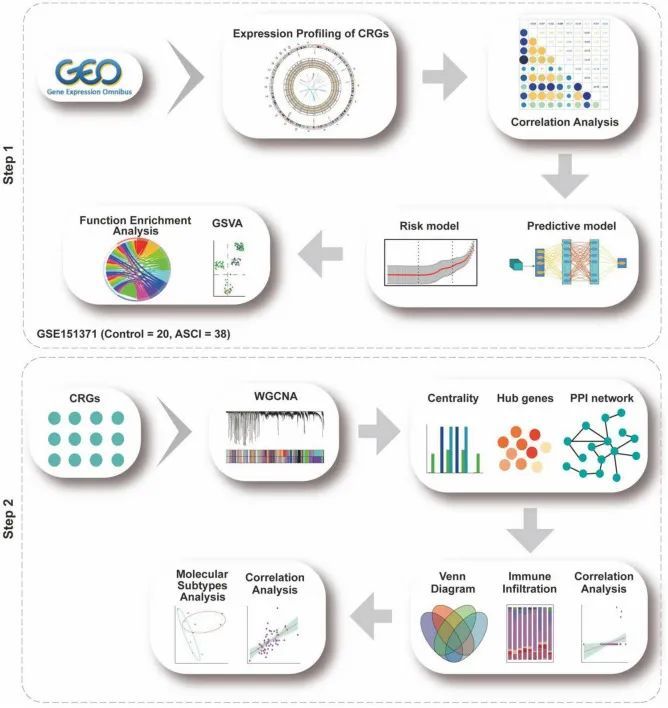
ASCI中CRGs的表达谱
CRG表达分布和染色体定位分析用于确定ASCI患者中CRG的总体表达情况(图2B,C)。接下来,作者使用Wilcoxon检验确定ASCI组中CRG的表达是否与对照组有所不同。结果表明MTF1,LIPT1,GLS,LIAS和CDKN2A的表达差异显著(图2A)。随后,作者对ASCI患者中的CRG进行差异基因表达分析。作者发现DLD和MTF1在ASCI患者中显著上调,而GLS,LIAS,LIPT1和FDX1在ASCI患者中显著下调(p值<0.05)(图2D)。为确保研究的全面性,作者将Wilcoxon检验和差异基因表达分析的结果进行了合并。
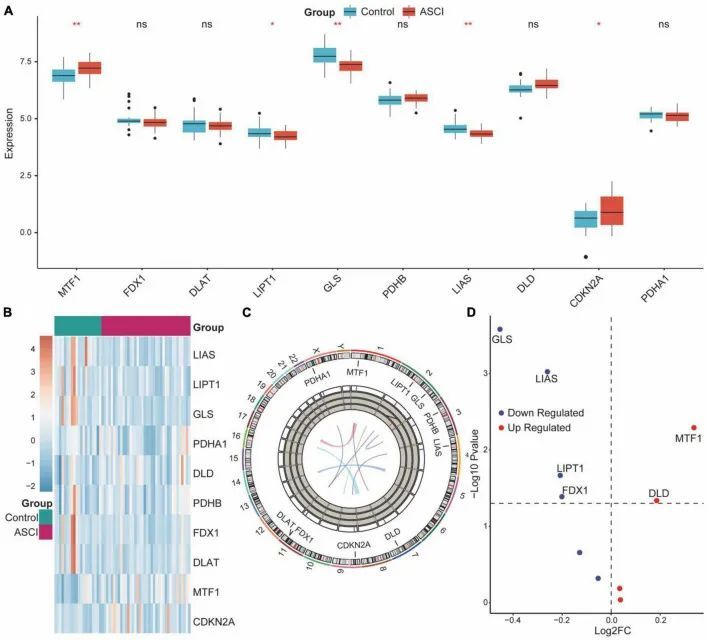
接下来,作者使用Spearman算法分析了CRGs中正负调节因子之间的相关性和相互作用(图3E)。DLD和MTF1之间存在正相关,而DLD、GLS和CDKN2A之间存在负相关(图3A-C)。相关系数大于0.7的基因被认为具有显著相关性,DLD和CDKN2A之间存在显著的负相关(图3D)。

风险模型的构建
为了分析ASCI中CRGs的表达,作者首先进行了单变量逻辑回归分析,以确定与ASCI相关的关键基因。作者采用了LASSO算法来缩小分析范围,并验证与ASCI相关的关键基因(图4B、D、E)。在多变量逻辑回归模型中,将ASCI相关的特征基因纳入,并确定GLS、LIAS和DLD为ASCI的独立风险因素(p值<0.05)(图4B)。根据多变量逻辑回归结果,构建了一个预测性诊断图来预测ASCI的风险(图4A)。校准曲线表明,基于ASCI的独立风险因素的预测性诊断模型能够以极高的准确性识别ASCI患者(图4C)。
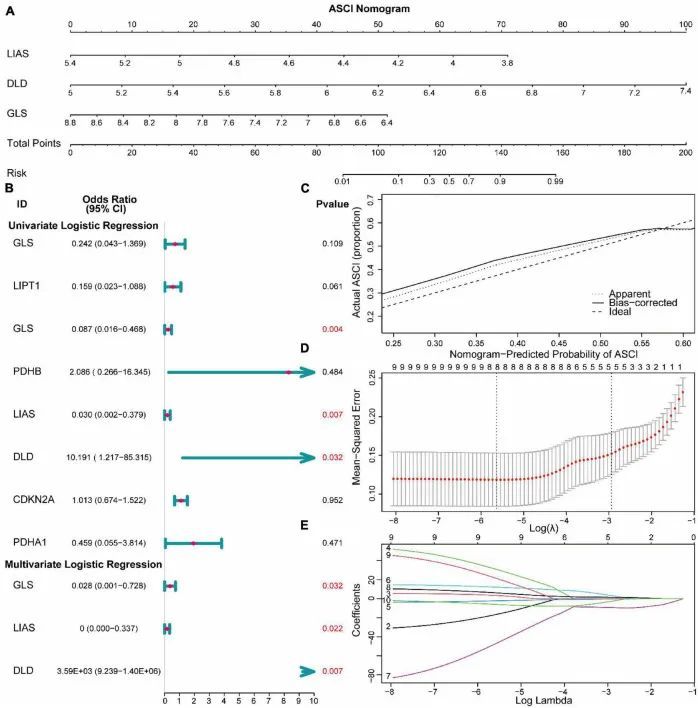
临床预测模型的构建
为了辅助临床诊断和治疗,作者将DLD表达水平和临床特征整合到作者的模型中,构建了一个带有分类器的反向传播神经网络架构(图5A)。根据校准曲线,该模型在训练集和验证集中表现出优秀的分类性能(图5B、C)。通过比较预测值和实际ASCI值来评估神经网络的性能,结果显示训练集和验证集的ROC曲线下面积(AUC)分别为0.8和0.757(图5D、E)。这些结果证实了神经网络临床预测模型在预测ASCI患者的神经功能方面的出色能力。此外,通过使用自定义惩罚函数,作者增强了神经网络模型对小数据集的拟合度,从而防止过拟合的发生。
功能富集分析
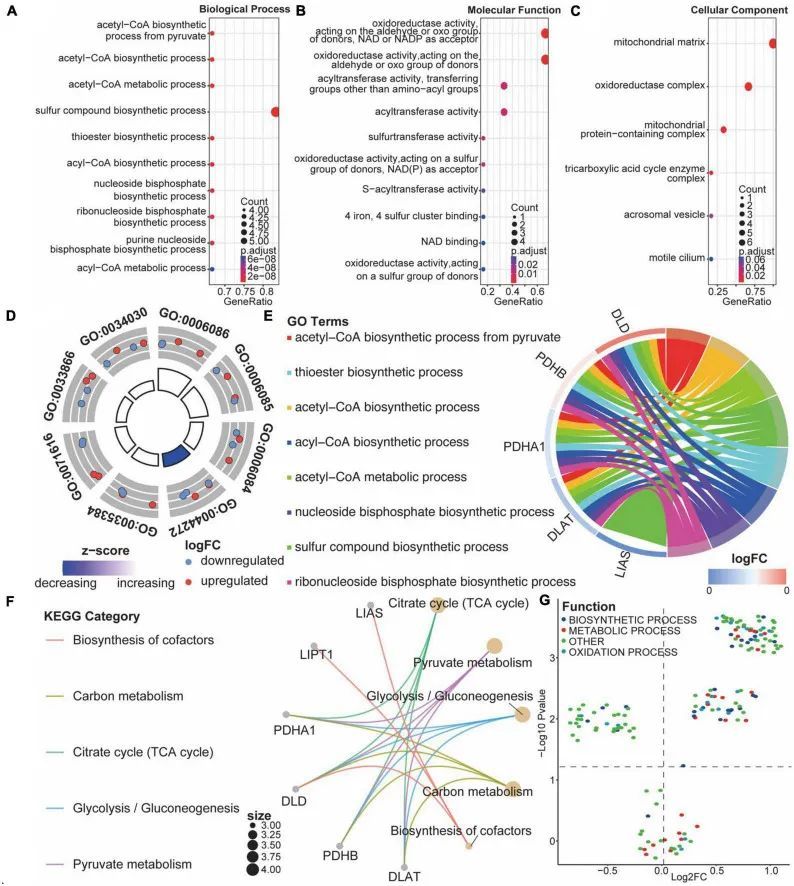
与对照组患者相比,作者分析了CRGs对生物相关功能的影响。CRGs的GO功能注释结果显示,生物过程主要由差异表达基因主导,如从丙酮酸合成乙酰辅酶A、乙酰辅酶A代谢过程和乙酰辅酶A生物合成过程(图6A);分子功能包括抗氧化活性、对供体的醛或酮基作用、以NAD或NADP为受体的酰基转移酶活性和硫转移酶活性(图6B);细胞组分包括线粒体基质、氧化还原酶复合物和含线粒体蛋白的复合物(图6C)。GO生物过程的前八个富集结果研究了CRGs的调控(图6D、E)。接下来,作者对CRGs在KEGG通路中的富集进行了交互研究,结果表明这些CRGs富集在柠檬酸循环(TCA循环)、丙酮酸代谢和糖酵解/糖新生等通路中(图6F)。
加权基因共表达网络分析(WGCNA)
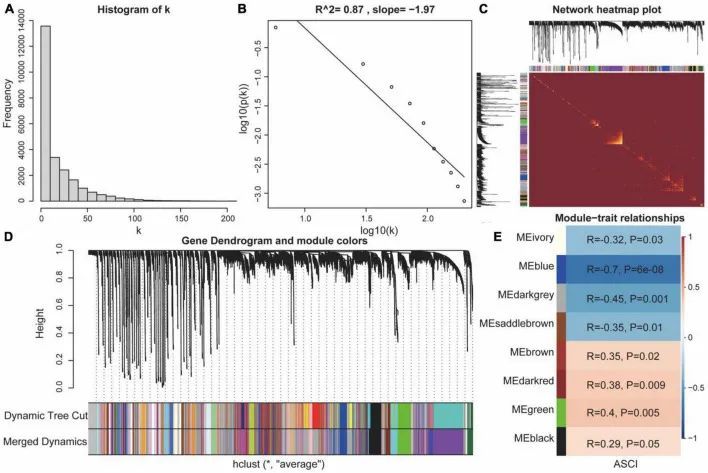
为了分析ASCI的特征基因集,作者使用GSE151371芯片上的所有基因进行了WGCNA分析。首先,作者对样本进行了层次聚类分析;然后,去除了异常样本,并使用动态剪枝树来识别网络模块(图7D)。在选择最佳软阈值后,验证了无标度网络。结果显示R = 0.87,斜率= -1.97,无标度网络已成功建立(图7A-C)。在排除灰色模块后,作者使用无标度网络模块和外部模块(ASCI)进行了相关性分析,发现象牙色、蓝色、深灰色、马鞍棕色、棕色、深红色、绿色和黑色模块与ASCI之间存在显著关系(p值<0.05)(图7E)。
ASCI组和对照组之间的CRG的PPI网络
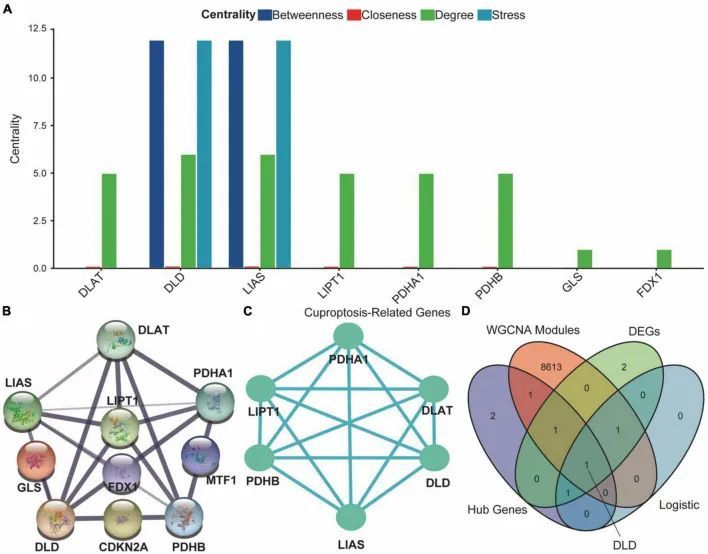
作者通过从ASCI和对照组中提取CRG的蛋白质相互作用网络来探索PPI网络的差异。CRG的PPI网络是使用STRING数据库构建的,包含17个相互作用关系和十个CRG,具有0.7的置信指数,0.733的平均局部聚类系数和1.11e-16的富集p值(图8B)。接下来,作者使用Cytoscape软件提取PPI网络的功能相互作用子网络(图8C)。作者还分析了PPI网络节点在四个维度上的中心性:介数中心性、接近中心性、度中心性和压力中心性。结果表明,DLD和LIAS在PPI网络中占据关键位置(图8A)。在对所有CRG、与ASCI相关的WGCNA模块、差异表达的CRG和多元逻辑回归进行共表达分析后,作者发现DLD不仅与ASCI高度相关,而且在ASCI后表达水平发生了显著变化(图8D)。因此,铜死亡调节因子DLD可能在ASCI中发挥重要作用,这是作者下一步分析的重点。
ASCI组和对照组的免疫浸润和相关性
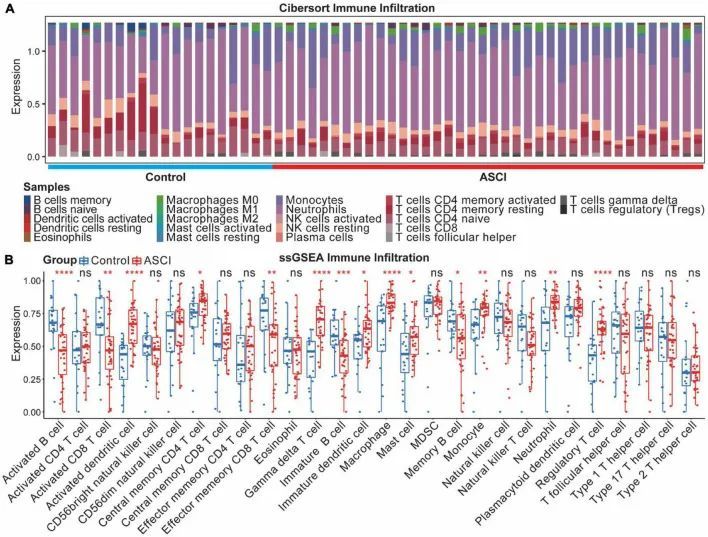
ASCI患者使用CIBERSORT算法评估其免疫特征和免疫细胞浸润水平(图9A)。为了进一步阐明ASCI患者的免疫微环境变化,作者使用ssGSEA估计了免疫细胞浸润的程度(图9B)。在ASCI后,激活的B细胞和激活的CD8 T细胞数量显著减少,而巨噬细胞数量显著增加(p值<0.05)。为了评估免疫浸润分析的稳定性,作者使用了几种免疫浸润算法进行验证,并得出了类似的结论。
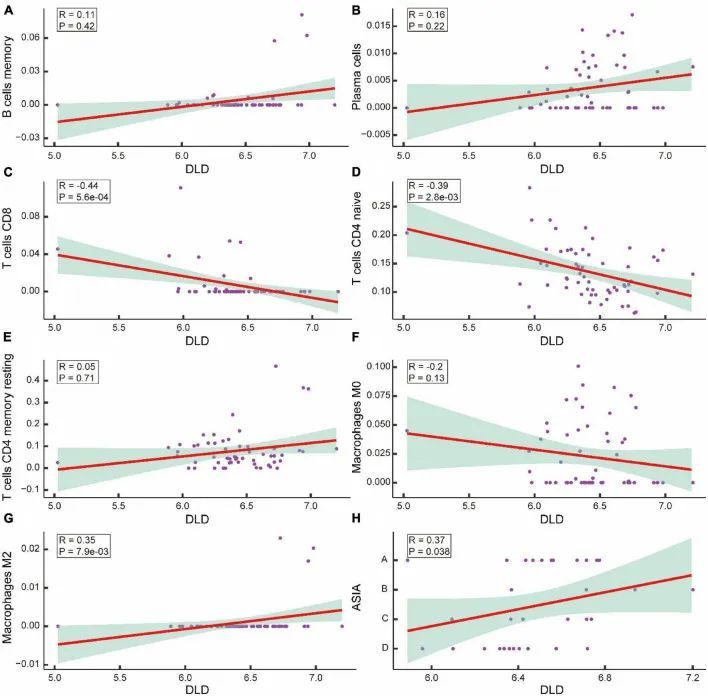
为了确定CRGs在ASCI后改变的免疫环境中是否起作用,作者分析了DLD与差异表达的T细胞、B细胞、浆细胞和巨噬细胞之间的相关性。当p值小于0.05时,相关性被认为是显著的。结果表明,DLD与CD8 T细胞呈显著负相关(R = -0.44,p = 5.6e-04)(图10C),DLD与CD4初级T细胞呈显著负相关(R = -0.39,p = 2.8e-0.3)(图10D),DLD与M2巨噬细胞呈显著正相关(R = 0.35,p = 7.9e-03)(图10G)。DLD与其余免疫浸润细胞群体之间没有显著相关性(p值> 0.05)(图10A,B,E,F)。DLD与ASIA分级之间也存在显著正相关(R = 0.37,p = 0.038)(图10H)。作者分析了ASCI高组和ASCI低组患者中的M2巨噬细胞水平,以了解免疫细胞异常在ASCI疾病进展中的作用。结果显示,ASIA高组的巨噬细胞M2含量显著较高(p值< 0.05)。此外,M2巨噬细胞数量和ASIA水平呈显著正相关(R = 0.12,p = 0.046)。这表明外周血巨噬细胞M2在ASCI过程中起着重要作用。
ASCI相关分子亚型的构建和相关性分析
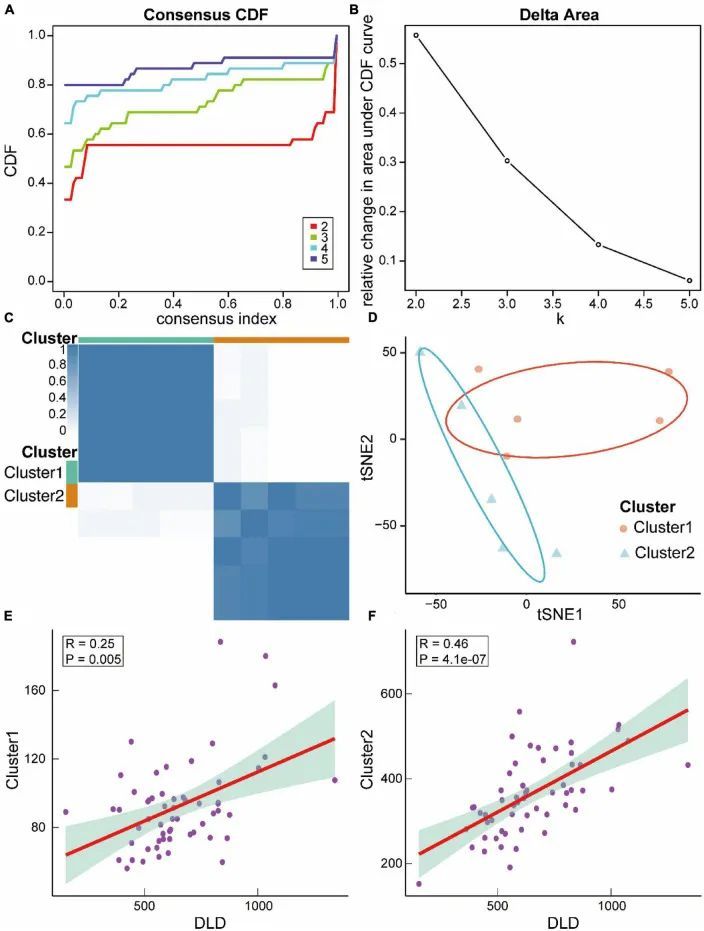
然后,作者根据它们的分子特征构建了ASCI亚型。根据累积分布函数(CDF),最佳方案是有两个亚型,分别命名为Cluster1和Cluster2(图11A-C)。为了验证ASCI分子分型的效果,进行了tSNE分析。结果表明,Cluster1和Cluster2具有出色的分辨率(图11D)。最后,作者计算了ASCI关键基因DLD与两个ASCI分子亚型之间的关联,发现Cluster1(R = 0.25,p = 0.005)和Cluster2(R = 0.46,p = 4.1e-07)与DLD显著正相关(图11E,F)。
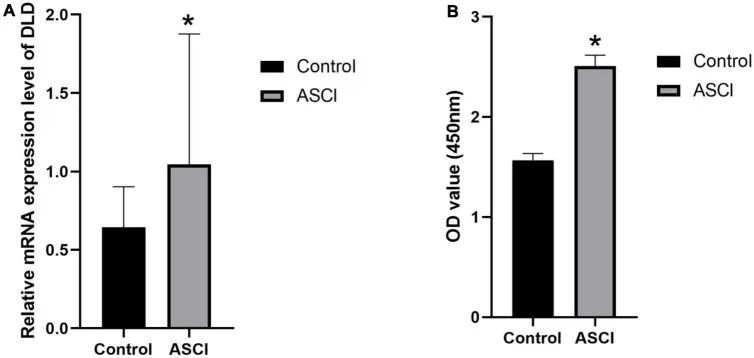
qRT-PCR和ELISA实验证实了ASCI后白细胞中DLD表达的增加。
为了验证ASCI后DLD的表达变化,作者从实验组和对照组的患者中提取了外周白细胞。qRT-PCR和ELISA实验证明,ASCI后白细胞中的DLD在mRNA和蛋白水平上显著增加(图12A,B)。这些结果表明,ASCI后DLD可能与外周白细胞的免疫浸润有关。
总结
总之,作者的研究强调了DLD作为ASCI的生物标志物和治疗靶点的潜力,以及它与影响患者预后的M2巨噬细胞水平的关系。为了更好地诊断和治疗,作者开发了一个临床预测模型和神经网络模型。尽管存在局限性,但作者的发现强调了ASCI中代谢途径和免疫微环境的重要性,鼓励了对这一主题的进一步研究。
)





)







)



-trait)
