做完转录组分析之后,一般都要求做qRT-PCR来验证二代测序得到的转录本表达是否可靠。荧光定量PCR是一种相对表达定量的方法,他的计算方法有很多,常用的相对定量数据分析方法有双标曲线法,ΔCt法,2^-ΔΔCt法(Livak法),用参照基因的ΔCt法和Pfaffl法。这里主要讲解常用的2^-ΔΔCt法(Livak法)如何计算;
qRT-PCR原理:
以基因的cDNA为模板进行PCR扩增,在PCR扩增过程中,通过收集荧光信号,对PCR进程进行实时检测。由于在PCR扩增的指数时期,模板的Ct 值和该模板的起始拷贝数存在线性关系,所以可以定量。
Ct值是什么意思呢?
Ct 值的含义是:每个反应管内的荧光信号达到设定的域值时所经历的循环数 (cycle)。 qRT-PCR在扩增的时候都会有平台期,在平台期之前,PCR 扩增就是简单的指数增长,也就是 1 变 2,2 变 4,4 变 8 …扩增。数学形式就是 2 的 ct 次方,到了平台期所有基因扩增的数目是一致的,而唯一有区别的则是 ct 值的不同。所以不难推断出 ct 值越小,反应扩增到达平台期所需循环数越少,目的基因起始含量越高。这里可以得到公式:


计算-ΔΔCt
在这里,我们有一个对照组,一个处理组,还有一个内参基因和目的基因,想看一下目的基因在处理组中相对与对照中的表达差异,也就是计算-ΔΔCt:数据如下:

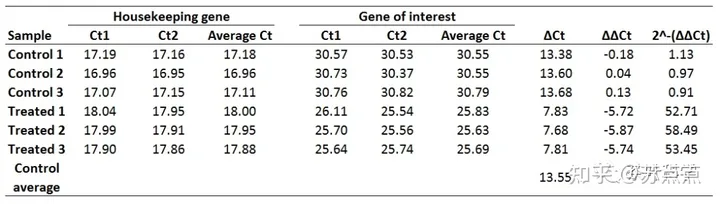
1.计算每组内参基因sgAction Ct均值

2.计算第一个 Δct,即每组的待检目的基因减去内参基因的 Ct 值

3.计算对照CK组中 Δct 的均值,再用处理组的 每一个Δct 减去刚刚计算的对照CK组的 Δct 均值,得到 ΔΔct(红框框)

4.相对表达量计算,也就是相对于对照组: 2^-ΔΔct:

不难看出这里的-ΔΔct和我们转录组当中的log2(fold change)值是一致的,所以如果多做几个基因就可以绘制类似如下图:

或者相关性点图:

方法二:
qPCR疑问解答:
qPCR经验之谈~mp.weixin.qq.com/s?__biz=MzU4MDkwMDg1NQ==&mid=2247485292&idx=2&sn=3c3b4a6bc081cad3cf9885a558a5b0cc&chksm=fd4e85f4ca390ce292c362a65a1b4aa96cd588c81175d31d67591f0fcbafb62d15a7ede436cb&payreadticket=HLmElvoD9e7mLxIpkqmCec18xG7Dn_wCNHcnclCAdTcn6VUED2d3Nf1g8e59r3yddyk0CtA#rd编辑![]() https://link.zhihu.com/?target=https%3A//mp.weixin.qq.com/s%3F__biz%3DMzU4MDkwMDg1NQ%3D%3D%26mid%3D2247485292%26idx%3D2%26sn%3D3c3b4a6bc081cad3cf9885a558a5b0cc%26chksm%3Dfd4e85f4ca390ce292c362a65a1b4aa96cd588c81175d31d67591f0fcbafb62d15a7ede436cb%26payreadticket%3DHLmElvoD9e7mLxIpkqmCec18xG7Dn_wCNHcnclCAdTcn6VUED2d3Nf1g8e59r3yddyk0CtA%23rd
https://link.zhihu.com/?target=https%3A//mp.weixin.qq.com/s%3F__biz%3DMzU4MDkwMDg1NQ%3D%3D%26mid%3D2247485292%26idx%3D2%26sn%3D3c3b4a6bc081cad3cf9885a558a5b0cc%26chksm%3Dfd4e85f4ca390ce292c362a65a1b4aa96cd588c81175d31d67591f0fcbafb62d15a7ede436cb%26payreadticket%3DHLmElvoD9e7mLxIpkqmCec18xG7Dn_wCNHcnclCAdTcn6VUED2d3Nf1g8e59r3yddyk0CtA%23rd
2–∆∆Ct 是一种计算实时荧光定量PCR(qPCR)时候计算样品中某个基因的相对表达量的方法。该法由Kenneth Livak和Thomas Schmittgen于2001年设计,已经被广泛使用。

Ct值代表了样品的循环阈值,这是在跑荧光定量PCR的时候,机器反馈给你的一个数值。真正的含义是PCR过程中产物扩增出现的荧光信号达到了设定的阈值之后,对应的循环数。例如 Ct = 19,说明这个产物扩张到第19个循环的时候才达到了设定的荧光阈值。也就可以侧面反映这个PCR时候模板的起始浓度,浓度越高,Ct值出现得越低。
delta:意思是两个值之差
![]()
上面的公式就是用实验组的 ΔCt 减去 空白组的 ΔCt得到的 ΔΔCt 。
而 ΔCt 由以下公式得到:
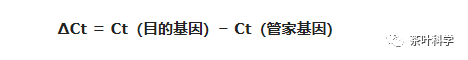
管家基因,也就是内参基因。ΔCt是用目的基因的Ct减去内参基因得到的差值。
什么是管家基因/内参基因?一般是指不受时空等其他因素影响,始终能稳定高表达的一类基因。常用的有β-Actin、GAPDH、18S、UBQ、EF-1α、TIP41。
- β-Actin:β-肌动蛋白
- GAPDH:3-磷酸甘油醛脱氢酶
- 18S:18S核糖体RNA
- EF-1α:延伸因子-1α
- UBQ:泛素酶
如果你有一个内参基因,可以参照以下案例进行计算:

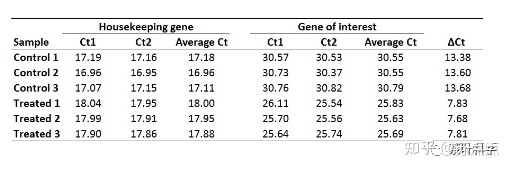
这是一份具有两个重复的qPCR的Ct值,分别为Ct1和Ct2,housekeeping gene为管家基因,另一个是你需要研究的基因。
1. 平均化技术重复的Ct值。则求每个样品的Ct1和Ct2的平均值,可得:

2. 计算每个样品的ΔCt值。如Control 1(空白对照组1)的ΔCt为:
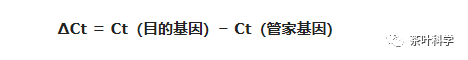
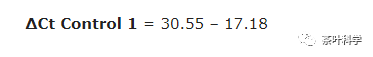
所有样品的ΔCt值如下:
3. 选择一个校准/参考样品用来计算ΔΔCt
用哪个样品或者样品组作为校准或参考,这一步会迷惑许多人,但其实取决于你的实验设置。
一般来说你可以将任意一组作为校准/参考都是可以的,也就是说你用Control或Treated,但是一般我们会用空白对照组为标准,研究实验处理的基因表达量变化。或者如果是研究不同品种之间的基因表达量,一般不用研究的那个品种作为标准。
还有一种方法就是选择用Ct值较高的一组作为参考组。
这里选择用Control组的生物学重复计算平均的ΔCt值作为参考,也就是:

值得注意的是,如果在计算平均ΔCt的时候,每个ΔCt变化较大,这时候不建议用算数平均值,而选择用几何平均值,这样会更好处理我们的异常值。例如这里的Control组Ct值是:13.38、13.60和15.80时,我们选择用几何平均值:
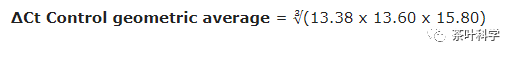
4. 计算ΔΔCt值。用每个样品所得的ΔCt减去第三步的平均ΔCt。
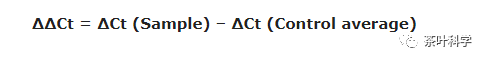
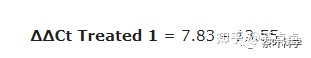

5. 计算 2^-(∆∆Ct)值,即为每个基因的相对表达量


最后在统计分析的时候,直接使用 2^-(∆∆Ct)值进行分析可能不会呈现正态分布且偏态严重,这时候可以用log公式进行转化,再进行后续的统计分析。即:log( 2^-(∆∆Ct))。

——第106天:Pyecharts绘制多种炫酷桑基图参数说明+代码实战)

















