今天给同学们分享一篇非肿瘤+氧化应激+WGCNA的生信文章“Identification of oxidative stress-related biomarkers associated with the development of acute-on-chronic liver failure using bioinformatics”,这篇文章于2023年10月10日发表在Scientific Reports期刊上,影响因子为4.6。

急性慢性肝衰竭(ACLF)是一种独特的综合征,其特征是慢性肝病急性失代偿、多器官功能衰竭和高短期死亡率。ACLF的病理生理机制主要包括强烈的全身性炎症、免疫功能障碍、线粒体功能障碍、代谢变化和氧化应激。迄今为止,除了肝移植外,对于ACLF还没有明确有效的治疗策略。ACLF管理的主要原则是治疗诱发事件或相关并发症,并提供器官支持治疗。迫切需要进一步探索ACLF发展和进展的病因学,以制定更有效的治疗策略,降低该疾病的高死亡率。
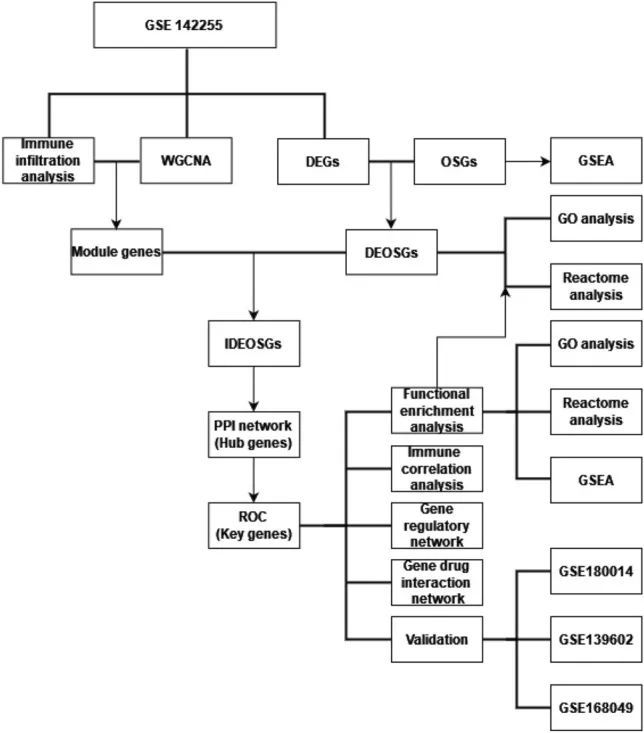
图1 本研究的流程图
1. 鉴定差异表达基因(DEGs)和差异表达有机物基因(DEOSGs)
从数据集GSE142255中筛选出了1228个不同表达的基因(DEGs),包括432个上调基因和796个下调基因(图2A、B)。为了进一步确定这些DEGs的来源和通路,作者使用BTMs作为参考基因集进行了GSEA分析。结果显示,上调的DEGs在与TLR和炎症信号传导、单核细胞、细胞周期和转录、单核细胞表面标志、免疫激活通用簇和细胞外基质相关的细胞系或通路中显著富集,而下调的DEGs在与T细胞激活、信号传导和分化、T细胞表面标志、NK细胞和MHC-TLR7-TLR8簇相关的细胞系或通路中显著富集(图2C)。在1228个DEGs和1093个氧化应激相关基因(OSGs)之间进行交集分析后,得到了79个差异表达的氧化应激相关基因(DEOSGs)(图2D)。
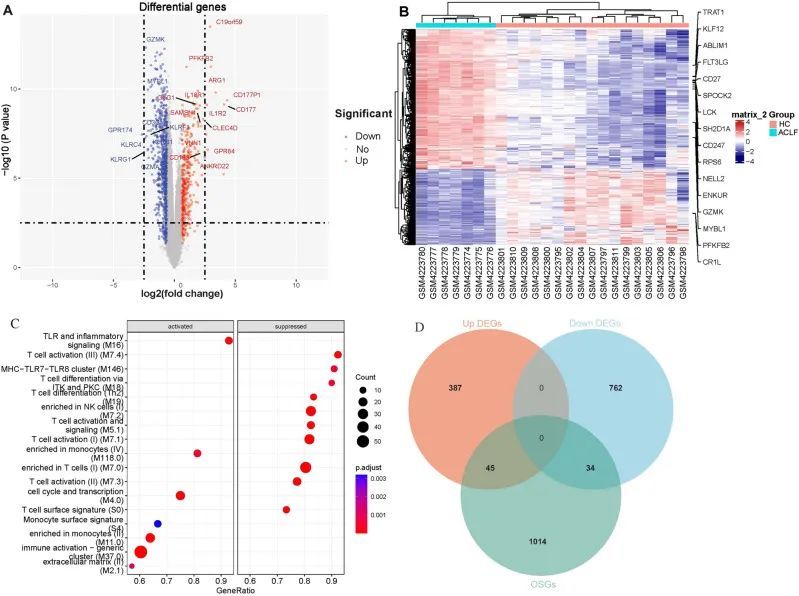
图2 ACLF中的DEGs和DEOSGs
2. DEOSGS的功能富集分析
GO富集分析显示,上调的差异表达氧化应激基因(DEOSGS)在与炎症反应调节、对肽的反应、对细菌源分子的反应、对脂多糖的反应、对氧化应激的反应等生物过程中显著富集(图3A),而下调的DEOSGS在与肽酰丝氨酸修饰、肽酰丝氨酸磷酸化、炎症反应调节、金属离子转运调节和对氧化应激的反应等生物过程中显著富集(图3B)。Reactome富集通路分析显示,上调的DEOSGS在与先天免疫反应、中性粒细胞颗粒溶解、白细胞介素信号传导、细胞因子信号传导和白细胞介素4/13信号传导等信号通路中显著富集(图3C),而下调的DEOSGS在与细胞因子信号传导、白细胞介素信号传导、白细胞介素4/13信号传导、细胞对热应激的反应和白细胞介素12刺激后的JAK STAT信号传导等信号通路中显著富集(图3D)。
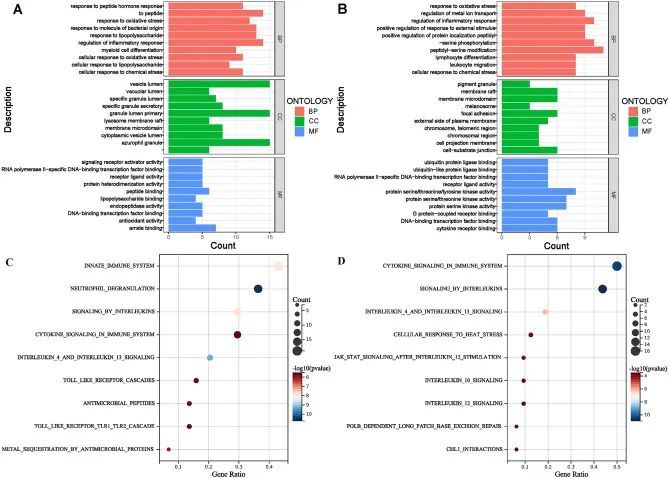
图3 不同表达的氧化应激基因(DEOSGS)的功能富集分析
3. 不同表达的氧化应激基因(DEOSGS)的功能富集分析
在基因集GSE142255中,使用氧化应激相关基因(OSGs)的表达信息进行基因集富集分析(GSEA)。使用c5.go.bp.v2023.1.Hs.symbols.gmt作为基因集的GSEA显示,ACLF与与细菌防御反应、真菌防御反应、创伤炎症反应、线粒体基因表达、线粒体翻译和肽代谢过程相关的生物过程显著相关(图4A)。使用c2.cp.reactome.v2023.1.Hs.symbols.gmt作为基因集的GSEA显示,ACLF与与先天免疫系统、中性粒细胞颗粒溶解、抗微生物肽、DNA修复和翻译相关的途径显著相关(图4B)。
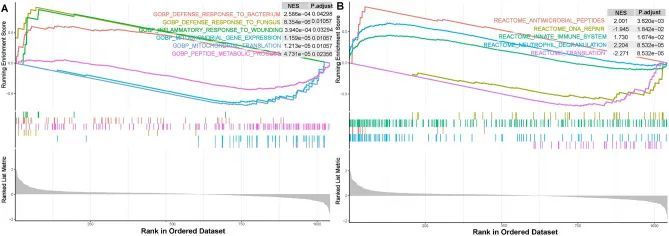
图4 基因集富集分析(GSEA)
4. 免疫浸润分析
如功能富集分析所示,DEOSGs和OSGs在生物过程和免疫应答相关的通路中得到了显著富集。因此,作者进一步使用CIBERSORT算法研究了GSE142255中基因表达与免疫细胞浸润之间的关系,并将结果可视化为热图(图5A、B)。在ACLF患者和健康受试者样本中,六种免疫细胞的丰度存在显著差异(P < 0.05),包括B细胞记忆型、CD4记忆型静止T细胞、CD4记忆型活化T细胞、CD8 T细胞、M0巨噬细胞和中性粒细胞(图5C)。在这六种不同浸润的免疫细胞中,中性粒细胞与CD8 T细胞呈显著负相关(P < 0.05)(图5D)。
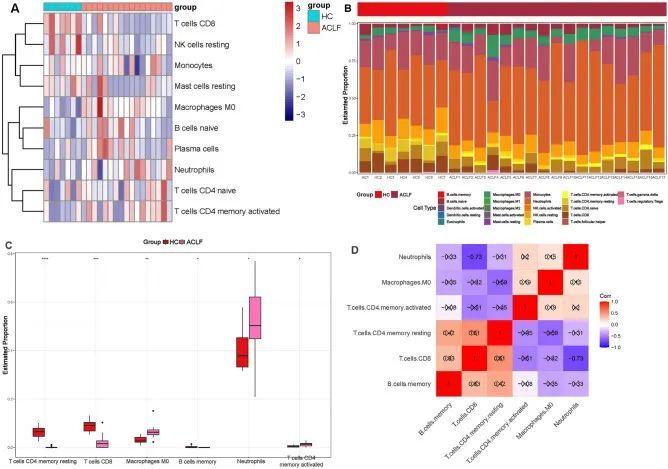
图5 免疫浸润分析
5. 加权基因共表达网络分析(WGCNA)
为了确定与ACLF高度相关的免疫相关基因,作者进行了WGCNA分析。作者发现了一个异常样本并将其删除(图6A)。根据尺度独立性和平均连接性,作者将β = 10设置为软阈值(图6B)。基于这个指数,生成了15个基因共表达模块(GCMs)(图6C)。其中,棕色、蓝色、青色、棕黄色和绿宝石模块与T细胞CD8、CD4记忆静止细胞和中性粒细胞呈高度相关(相关系数> 0.7,P < 0.001)(图6D)。因此,这些模块被视为后续分析的关键模块。随后,将包含在关键模块中的3668个基因命名为免疫相关模块基因。功能富集分析表明,这些模块基因主要富集在与免疫反应、激活或调节相关的通路中(图6E,F)。
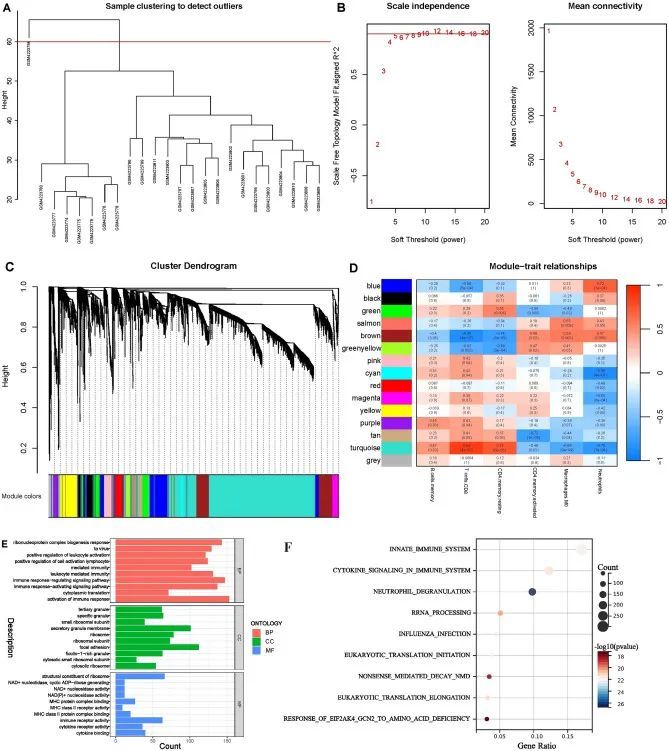
图6 基于加权基因共表达网络分析基因集
6. 构建PPI网络和筛选中心基因
通过79个差异表达的氧化应激相关基因(DEOSGs)和3668个免疫相关模块基因的交集,共鉴定出67个免疫相关氧化应激差异表达基因(OSDEGS)(图7A)。将DEOSGs上传至STRING数据库后,构建了蛋白质相互作用(PPI)网络,并使用Cytoscape软件进行可视化(图7B)。在PPI网络中,通过Cytoscape的MCODE插件鉴定出最密集连接的簇(18个节点和117条边),即簇1(图7C)。通过MCC算法在簇1中筛选出的前10个中心基因包括C-C趋化因子4(CCL4)、C-C趋化因子5(CCL5)、整合素α-M(ITGAM)、干扰素γ(IFNG)、髓过氧化物酶(MPO)、基质金属蛋白酶-9(MMP9)、NF-κB抑制因子α(NFKBIA)、Toll样受体2(TLR2)、Toll样受体4(TLR4)和组织抑制金属蛋白酶-1(TIMP1)(图7D)。
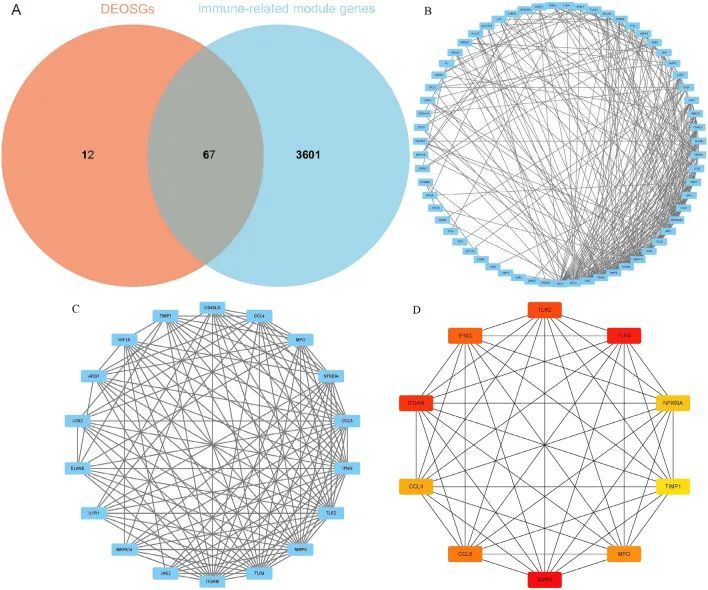
图7 蛋白质-蛋白质相互作用(PPI)网络和关键基因
7. 关键基因的鉴定
为了确定ACL肝衰竭的诊断和预后价值,作者进行了受试者工作特征曲线(ROC)分析。在GSE142255数据集中,所有前10个中心基因的曲线下面积(AUC)值均大于0.7(图8A-C)。在GSE180014数据集中,AUC大于0.7的中心基因包括IFNG、MMP9、MPO、CCL5、ITGAM、TLR2、TLR4和TIMP1(图8D-F)。在GSE139602数据集中,AUC大于0.7的中心基因包括IFNG、MPO、CCL5、ITGAM、NFKBIA、TLR2、TLR4和TIMP1(图8G-I)。在GSE168049数据集中,AUC大于0.7的中心基因包括MPO、CCL5、MMP9、ITGAM、TLR2、TLR4和TIMP1(图8J-L)。总之,共有6个中心基因(MPO、CCL5、ITGAM、TLR2、TLR4和TIMP1)在四个数据集中一致表现出良好的诊断或预后价值,并因此被命名为关键基因。
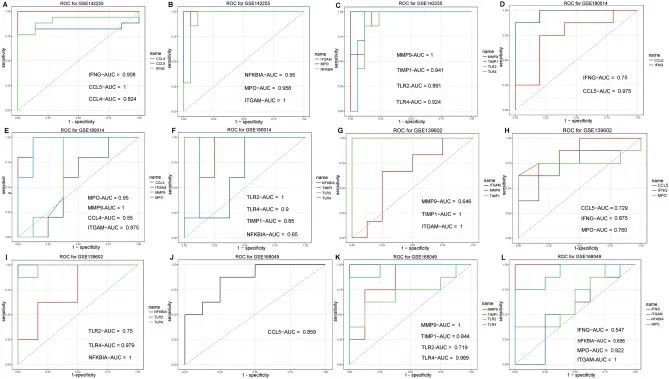
图8
8. 关键基因的基因表达水平
为了确定ACLF和HC之间关键基因表达的差异,作者对这两个组进行了独立样本t检验。在数据集GSE142255和GSE180014中,与HC组的基因表达水平相比,ACLF组的CCL5显著下调,而其他5个关键基因显著上调(P < 0.001)(图9A,B)。在数据集GSE139602和GSE168049中,发现3个关键基因(CCL5,MPO和TLR2)没有显著调节(图9C,D)。
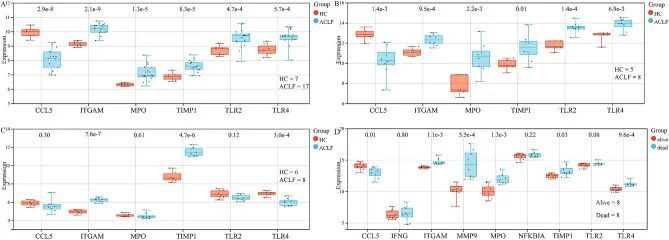
图9
9. 关键基因的功能富集分析
GO富集分析显示,关键基因主要富集在与对细菌来源分子的响应、对脂多糖的响应、髓系白细胞激活、巨噬细胞激活、脂多糖介导的信号通路、细胞对干扰素-γ的响应、基质金属蛋白酶分泌的调节以及对脂肽多糖酸的细胞响应等生物过程相关的领域(图10A)。Reactome富集分析显示,关键基因主要富集在与先天免疫系统、Toll样受体级联、白细胞介素信号传导、IRAK4缺陷TLR2/4和TLR内源性配体调节、免疫系统疾病、白细胞介素10信号传导、Toll样受体TLR1/TLR2级联以及抗原处理交叉呈递等通路相关的领域(图10B)。
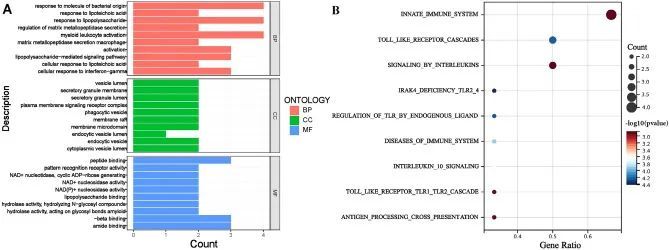
图10 关键基因的功能富集分析
10. 关键基因的基因集富集分析
为了探索关键基因的潜在功能,作者对单基因进行了基因集富集分析(GSEA),参考基因集为“c2.cp.kegg.v7.4.symbols.gmt”。结果显示,MPO、CCL5、ITGAM、TLR2、TLR4和TIMP1在高表达的队列中的基因在免疫和代谢相关途径中高度富集,例如抗原处理和呈递、自身免疫性甲状腺疾病、肠道免疫网络IGA产生、原发性免疫缺陷、鞘脂代谢、果糖和甘露醇代谢、半胱氨酸和甲硫氨酸代谢、丁酸代谢、嘌呤代谢、糖胺聚糖生物合成硫酸肝素、PPAR信号通路、糖胺聚糖降解、糖脂生物合成乳糖和新乳糖系列、泛酸和辅酶A生物合成以及氨酰核糖酸生物合成(图11A-F),表明这些关键基因可能参与免疫应答和生物代谢过程。
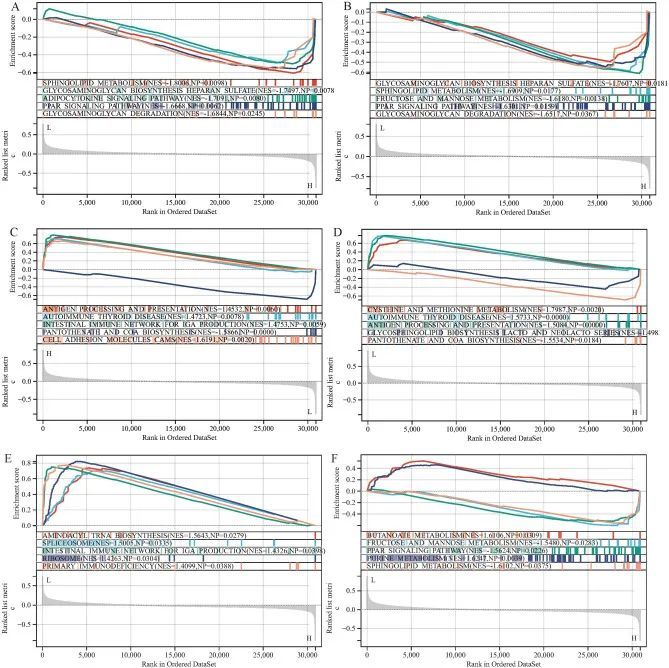
图11 TLR2(A),TLR4(B),CCL5(C),ITGAM(D),MPO(E)和TIMP1(F)的基因集富集分析(GSEA)
11. 关键基因与免疫细胞的相关性
为了确定关键基因与免疫细胞浸润的相关性,作者进行了Pearson相关分析。结果显示,CCL5与其他5个关键基因呈负相关,而这些关键基因之间呈正相关(图12A);除了CCL5(正相关)和MPO(无显著性相关)外,所有关键基因与CD8 T细胞呈显著负相关;MPO与TIMP1分别与静止记忆CD4 T细胞和活化记忆CD4 T细胞呈显著负相关和正相关。CCL5与TLR4分别与中性粒细胞呈负相关和正相关(图12B)。
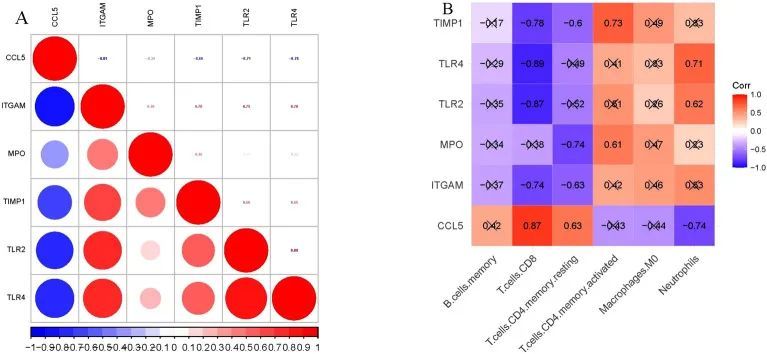
图12 关键基因之间的相关性
12. 识别调控关键基因的转录因子和miRNA
为了确定miRNA和转录因子对关键基因在转录水平上的调控影响,作者获取了miRNA和转录因子与关键基因的相互作用网络,并使用Cytoscape软件进行可视化。总共有23个、22个、19个、7个、4个和3个miRNA与TLR4、TIMP1、CCL5、TLR2、MPO和ITGAM相互作用(图13A)。总共有8个、7个和5个转录因子与ITGAM、TLR2/TLR4/TIMP1和MPO/CCL5相互作用(图13B)。两个miRNA(hsa-mir-129-2-3p和hsa-mir-210-3p)与3个关键基因相互作用,两个转录因子(FOXC1和HNF4A)与4个关键基因相互作用,表明这些miRNA和转录因子可能与关键基因之间有更密切的相互作用。
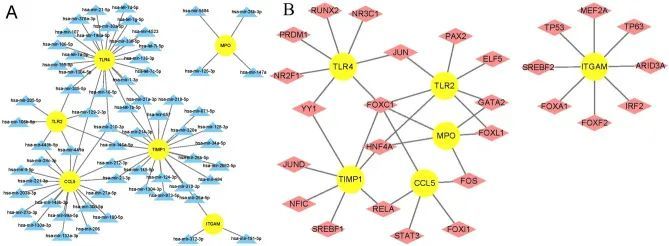
图13 关键基因的调控网络
13. 潜在有效药物的鉴定
为了探索针对关键基因的潜在有效药物,作者从药物-基因相互作用数据库(DGIdb)获取了基因-化学物质相互作用网络,并使用Cytoscape软件进行可视化(图14)。在6个关键基因中,TLR2、ITGAM、TLR4和MPO分别与4个、10个、11个和19个药物/化学物质有交集。在41种药物中,芬太尼、二甲基亚砜和茶碱与两个关键基因(MPO和ITGAM)有交集。
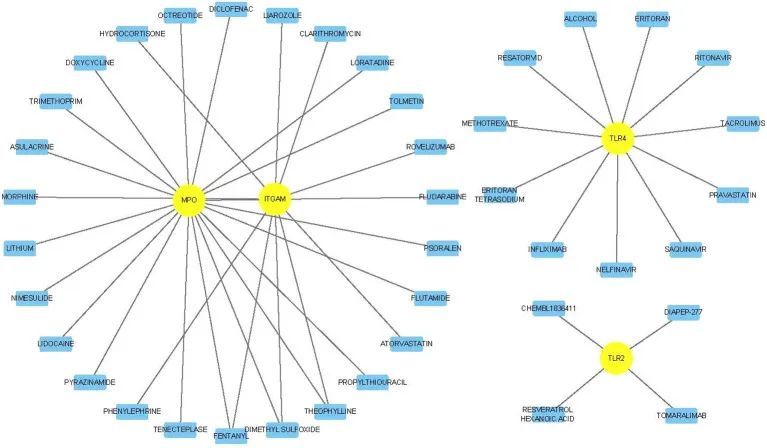
图14 药物-关键基因相互作用网络
总结
总之,本研究利用综合生物信息学方法探讨了氧化应激在ACLF发生和进展中的作用。作者确定了与ACLF的诊断和预后密切相关的六个免疫和氧化应激相关基因。此外,作者构建了一个关键基因的调控网络,并探索了一些针对这些关键基因的药物。本研究加深了作者对氧化应激对ACLF发病机制和预后的影响的理解,并为有效的分子靶向治疗策略提供了更多的见解。作者仍需要进行更多的前瞻性研究和进一步的实验证实作者的结果。







![[Java]前中后序遍历二叉树/递归与非递归](http://pic.xiahunao.cn/[Java]前中后序遍历二叉树/递归与非递归)
详解)










