小罗碎碎念
本期文献主题:人工智能+病理组学的交叉课题,患者的临床特征如何收集与整理
我们在阅读文献的时候会发现,有的文章会详细给出自己的数据集分析表,分别列出训练集、验证集的数量,以及每个特征对应的患者人数。今天选择的五篇文献就属于这一类,并且我还专门把每篇文献对应的IF整理了一下。

我们会发现,这几篇文章的IF还算是比较高的,并且我们准备一个这样的表格,也方便自己分析。收集数据是第一步,并且后续可能还会持续的补充数据加入我们的训练集,因此我整理了这一期推文,让大家了解一下,做病理组学相关的文章,样本量大概需要多少,以及需要查哪些临床指标。
只有把这些都弄清楚,并且确定无误以后,才能保证我们后续的实验不会出现原则性的错误。我是罗小罗同学,我们下期见!!

推文预告
- 人工智能+影像组学的交叉课题,患者的临床特征如何收集与整理
- 人工智能+基因组学的交叉课题,患者的临床特征如何收集与整理
一、AI辅助的肿瘤浸润性淋巴细胞空间分析:非小细胞肺癌免疫检查点抑制剂治疗的新生物标记

一作&通讯
| 角色 | 姓名 | 单位 |
|---|---|---|
| 第一作者 | Sehhoon Park, MD, PhD | 韩国三星医疗中心,成均馆大学医学院 |
| 并列第一作者 | Chan-Young Ock, MD, PhD | Lunit,首尔,韩国 |
| 并列第一作者 | Hyojin Kim, MD, PhD | 韩国首尔国立大学盆唐医院病理系 |
| 通讯作者 | Se-Hoon Lee, MD, PhD | 韩国三星医疗中心,成均馆大学医学院 |
| 并列通讯作者 | Yoon-La Choi, MD, PhD | Lunit,首尔,韩国 |
| 并列通讯作者 | Tony S. Mok, MD | 香港中文大学临床肿瘤学系 |
文献概述
该研究开发了一种基于人工智能(AI)的全切片图像(WSI)分析工具,用以评估肿瘤浸润性淋巴细胞(TIL)的空间分布,并将其作为预测非小细胞肺癌(NSCLC)患者对免疫检查点抑制剂(ICI)反应的辅助生物标记。
研究的主要发现和结论如下:
-
目的:传统的基于TIL的生物标记在预测ICI的疗效方面具有潜力,但由于方法学限制和在WSI上进行TIL分布的空间分析过程繁琐,其临床应用面临挑战。
-
方法:研究者开发了AI驱动的WSI分析器,能够定义三种免疫表型(IPs):炎症型、免疫排除型和免疫荒漠型。这些IPs与晚期NSCLC患者对ICI的反应和生存相关联。
-
结果:炎症型IP与局部免疫细胞溶解活性的增强、更高的反应率和更长的无进展生存期(PFS)相关,与免疫排除型或免疫荒漠型患者相比。AI模型确定的肿瘤比例评分(TPS)与传统病理学家分析的控制TPS显著正相关。研究发现,44.0%的肿瘤为炎症型,37.1%为免疫排除型,18.9%为免疫荒漠型。不同PD-L1 TPS水平下的炎症型IP发生率分别为31.7%、42.5%和56.8%。与免疫表型相关的中位PFS和总生存期(OS)分别为:炎症型IP 4.1个月和24.8个月,免疫排除型IP 2.2个月和14.0个月,免疫荒漠型IP 2.4个月和10.6个月。
-
结论:AI驱动的TIL空间分析与晚期NSCLC患者对ICI的肿瘤反应和PFS相关,可能作为病理学家确定的TPS的补充生物标记。
-
研究背景:免疫肿瘤学(IO)在多种癌症类型中有效,ICI已在超过15种癌症类型中获批。目前NSCLC中唯一获批的伴随诊断测试是PD-L1表达,通过免疫组化(IHC)测量。
-
研究方法:Lunit SCOPE IO的开发使用了来自3,166个WSI的2.8 x 10^9 mm^2的H&E染色组织区域和6.0 x 10^5 TIL的数据,涵盖了25种癌症类型,包括NSCLC,这些数据由认证病理学家注释。
-
研究结果:AI模型在内部验证集中对CE、CS的分割和TIL的识别的AUROC分别为0.9715、0.9503和0.9252,在外部病理验证AUROC中分别为0.9539、0.9871和0.9591。通过多变量逻辑回归分析建立了多个生物标记的集合,以预测ICI反应者。
-
研究限制:这项回顾性研究的局限性在于患者群体的固有异质性,以及不同医疗机构之间的患者特征差异。
-
未来方向:研究表明,Lunit SCOPE IO可以与PD-L1 IHC同时处理H&E染色幻灯片。未来需要对Lunit SCOPE IO在晚期NSCLC治疗中的临床应用进行前瞻性研究。
基线数据
表1提供了参与这项研究的非小细胞肺癌(NSCLC)患者的详细特征。

- 患者总数:共有518名患者纳入研究。
- 年龄:年龄中位数为65岁,年龄范围从33岁到94岁。
- 性别:
- 女性:125名(24.1%)
- 男性:393名(75.9%)
- ECOG表现状态(Eastern Cooperative Oncology Group performance status,一种衡量患者功能状态的系统):
- 0分(无症状):26名(5.0%)
- 1分(轻度症状):415名(80.1%)
- 2分(中度症状):77名(14.9%)
- 吸烟史:
- 从未吸烟:147名(28.4%)
- 曾经吸烟:195名(37.6%)
- 目前吸烟:176名(34.0%)
- 免疫检查点抑制剂(ICI)药物类型:
- Pembrolizumab:229名(44.2%)
- Nivolumab:198名(38.2%)
- Atezolizumab:80名(15.4%)
- 其他:11名(2.1%)
- 治疗线:即ICI是作为第几线治疗:
- 第一线:43名(8.3%)
- 第二线:264名(51.0%)
- 第三线或以上:211名(40.7%)
- 组织获取方式:
- 手术:160名(30.9%)
- 活检:358名(69.1%)
- 组织来源部位:
- 原发肺:470名(90.7%)
- 胸膜:48名(9.3%)
- 病理类型:
- 腺癌:296名(57.1%)
- 鳞状细胞癌:158名(30.5%)
- 其他:64名(12.4%)
- 分子亚型:
- EGFR突变:77名(14.9%)
- ALK易位:6名(1.2%)
- EGFR/ALK阴性:406名(78.4%)
- 未知:29名(5.6%)
- 组织获取时的肝脏转移情况:
- 无:497名(95.9%)
- 有:21名(4.1%)
续表1
-
胸膜转移情况:
- 在组织获取时没有胸膜转移:381名(73.6%)
- 在组织获取时有胸膜转移:137名(26.4%)
-
ICI治疗时的胸膜转移情况:
- 在ICI治疗时没有胸膜转移:346名(66.8%)
- 在ICI治疗时有胸膜转移:172名(33.2%)
-
脑转移情况:
- 在组织获取时没有脑转移:446名(86.1%)
- 在组织获取时有脑转移:72名(13.9%)
-
ICI治疗时的脑转移情况:
- 在ICI治疗时没有脑转移:399名(77.0%)
- 在ICI治疗时有脑转移:119名(23.0%)
-
从组织获取到ICI治疗的时间间隔:
- ≤1年:320名(61.8%)
- 大于1年:198名(38.2%)
-
PD-L1肿瘤比例评分(TPS)(续):
- 0%:104名(23.4%)
- 1%-49%:134名(30.2%)
- ≥50%:206名(46.4%)
图表分析
图2
图2详细描述了基于Lunit SCOPE IO技术支持的肿瘤浸润性淋巴细胞(TIL)空间分析对免疫表型(IP)的分类。

A. TIL密度分布:
- 展示了在癌症上皮(CE)中TIL密度在不同队列(TCGA LUAD、LUSC、SMC和SNUBH)的分布情况。使用了不同颜色(蓝色、红色、青绿色)来区分不同的数据集。
- 同时展示了在同一队列中癌症基质(CS)的TIL密度分布。
- 还展示了1mm²网格大小下,H&E染色图像和Lunit SCOPE IO推断的掩膜图像,其中CE为黄色,CS为紫色,TIL为红色。
- 这部分展示了不同队列中TIL在癌症上皮和基质中的分布情况,为理解肿瘤微环境中的免疫细胞浸润提供了定量数据。
- 这有助于识别免疫表型与TIL的空间分布之间的关联,是研究免疫表型分类的基础。
B. 免疫表型与局部免疫细胞溶解活性的相关性:
- 展示了代表性IP与通过GZMA和PRF1基因表达量测量的局部免疫细胞溶解活性之间的相关性。"**“表示P值小于0.001,”*"表示P值小于0.05。
- 通过展示免疫表型与GZMA和PRF1基因表达的相关性,这部分揭示了不同免疫表型与肿瘤微环境中的细胞毒性活性之间的关系。
- 这有助于理解哪些免疫表型可能与更强的抗肿瘤免疫反应相关。
C. 免疫表型与肿瘤突变负荷的相关性:
- 展示了代表性IP与肿瘤突变负荷(TMB)之间的相关性,同样使用"**“和”*"来表示统计学显著性。
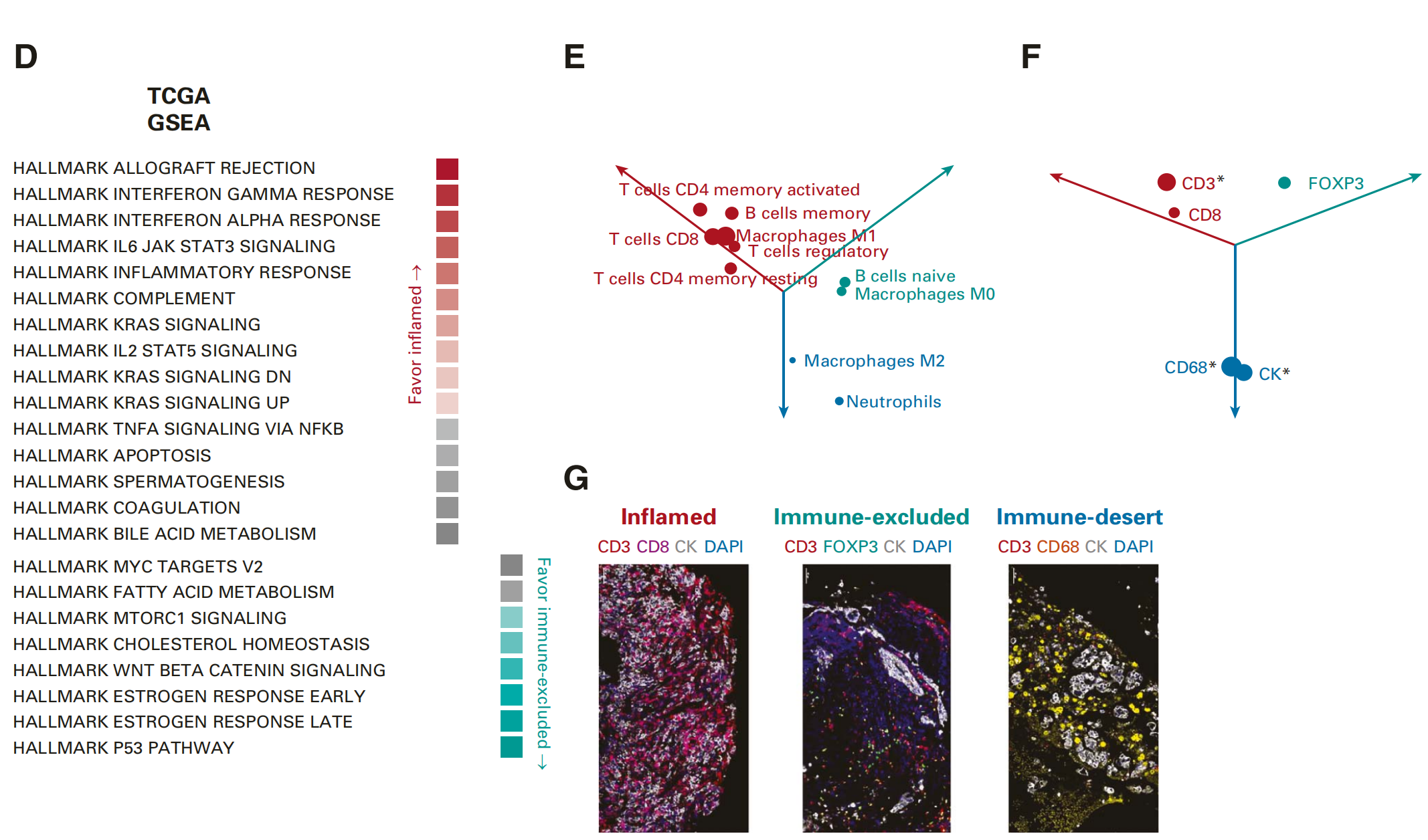
D. 基因集富集分析(ssGSEA):
- 利用HALLMARK基因集对TCGA LUAD和LUSC进行ssGSEA,并根据FDR(或q值)小于1%进行筛选。
- 展示了炎症型IP或其他IP(ssGSEA评分的均值乘以-log2 FDR值)的均值比率。
E. Cibersort分析:
- 对TCGA LUAD和LUSC进行Cibersort分析,筛选P值小于0.05的结果。
- 展示了在炎症型IP(红色)、免疫排除型IP(青绿色)和免疫荒漠型IP(蓝色)中富集的免疫细胞亚群。
- 每个点到原点的距离反映了每种IP与其他IP相比的均值比率乘以-log2 P值。
F. 多重免疫组化(IHC)的总结:
- 展示了SMC队列(99个样本)中表达细胞的定量分析结果,以DAPI染色细胞数量为标准化依据。
- 与E部分类似,展示了每种IP中富集的表达细胞的标准化计数。
G. 多重IHC图像示例:
- 展示了炎症型IP(左侧)、免疫排除型IP(中间)和免疫荒漠型IP(右侧)的代表性多重IHC图像。
整体来看,图2强调了Lunit SCOPE IO技术在分析TIL空间分布和分类免疫表型方面的应用,以及这些分类与免疫反应活性、肿瘤突变负荷和基因表达模式之间的相关性。这些分析有助于理解不同免疫表型对非小细胞肺癌患者免疫治疗反应的潜在影响。
图3
图3提供了Lunit SCOPE IO技术支持的免疫表型(IP)的全景和临床意义,以及它们与非小细胞肺癌(NSCLC)患者在接受免疫检查点抑制剂(ICI)治疗后的临床结果之间的关系。

A. 免疫表型和其他临床特征的比例:
- 这部分展示了每个患者炎症型(inflamed)、免疫排除型(immune-excluded)和免疫荒漠型(immune-desert)的得分比例,以及代表性IP的分布。
- 同时展示了EGFR突变和ALK易位的状态,PD-L1免疫组化(IHC)的肿瘤比例评分(TPS),以及根据RECIST v1.1标准评估的最佳总体反应。
- 这些数据在两个中心(SMC和SNUBH)的患者之间进行了比较。

B. 基于代表性免疫表型的无进展生存期(PFS)和总生存期(OS)的Kaplan-Meier分析:
- 这部分通过Kaplan-Meier曲线展示了不同免疫表型患者在接受ICI治疗后的PFS和OS。
- 曲线可以帮助观察不同免疫表型与患者生存期之间的关系,并提供中位生存期的估计。

C. 基于代表性免疫表型的一线铂类化疗后的PFS和OS的Kaplan-Meier分析:
- 类似于B部分,这部分展示了患者在接受一线铂类化疗后的PFS和OS的Kaplan-Meier曲线。
- 这有助于比较不同免疫表型对化疗反应的影响。
整体而言,图3强调了免疫表型分析在预测NSCLC患者对ICI治疗反应中的潜在价值。通过比较不同免疫表型与临床结果之间的关系,研究者能够识别可能从特定治疗策略中获益的患者群体。此外,该图还提供了有关基因突变、PD-L1表达水平和治疗反应之间相互作用的信息,这些信息对于个性化医疗和治疗决策至关重要。
图4
图4深入探讨了Lunit SCOPE IO技术支持的免疫表型(IP)如何特别在PD-L1肿瘤比例评分(TPS)为1%-49%的患者中,决定免疫检查点抑制剂的应答者。

A. HR森林图:
- 这部分展示了不同临床病理亚组的PFS风险比(HR)和95%置信区间(CI)。
- 森林图为研究者提供了不同亚组间治疗效果差异的视觉比较,点的大小通常与样本量相关,而置信区间的宽度表示统计学的不确定性。
B. 基于PD-L1 TPS的免疫表型比例:
- 这部分展示了根据PD-L1 TPS评分,炎症型(inflamed)、免疫排除型(immune-excluded)和免疫荒漠型(immune-desert)IP的比例。
- 通过不同颜色(红色、青绿色、蓝色)区分不同的IP,提供了PD-L1 TPS与免疫表型之间关系的直观表示。

C. 基于PD-L1 TPS状态和代表性IP的PFS Kaplan-Meier分析:
- 这部分通过Kaplan-Meier曲线展示了不同PD-L1 TPS状态和免疫表型组合的患者群体的PFS。
- 曲线可以帮助观察不同PD-L1 TPS和IP组合对患者PFS的影响,并提供中位PFS的估计。
D. ROC曲线预测免疫检查点抑制剂应答者:
- 这部分展示了Lunit SCOPE IO炎症型得分和PD-L1 TPS预测PD-L1 TPS 1%-49%亚组患者对免疫检查点抑制剂应答的ROC曲线。
- ROC曲线下面积(AUROC)提供了预测模型整体性能的度量,AUROC值接近1表示模型具有很好的预测能力。
整体而言,图4强调了免疫表型分析在预测免疫检查点抑制剂治疗反应中的重要性,特别是在PD-L1 TPS为1%-49%的患者群体中。通过森林图、不同IP的比例分析、Kaplan-Meier生存曲线和ROC曲线,研究者能够评估免疫表型与其他临床病理特征如何共同影响患者的治疗结果。这些信息对于个性化医疗和治疗决策具有重要意义,有助于识别最有可能从特定治疗策略中获益的患者。
二、机器学习揭示肿瘤浸润性淋巴细胞与肺癌免疫治疗反应的关联

一作&通讯
| 角色 | 姓名 | 职位 | 单位名称(中文) |
|---|---|---|---|
| 第一作者 | Mehrdad Rakaee | PhD | 挪威北极大学医学院、挪威北挪威大学医院 |
| 通讯作者 | David J. Kwiatkowski | MD, PhD | 哈佛医学院布里格姆和妇女医院、哈佛医学院丹娜-法伯癌症研究所 |
文献概述
这篇文章是一项关于非小细胞肺癌(NSCLC)患者使用免疫检查点抑制剂(ICI)治疗的研究,特别是探讨了基于机器学习(ML)的肿瘤浸润性淋巴细胞(TILs)评分方法与临床治疗结果之间的关联。
研究背景与目的:
- 目前对于预测肺癌患者对免疫检查点抑制剂治疗反应的生物标志物有限。
- 研究旨在开发一种基于机器学习的TILs评分方法,并评估TILs与接受ICI治疗的晚期非小细胞肺癌患者临床结果之间的关联。
研究设计、环境和参与者:
- 这项多中心回顾性发现-验证队列研究包括685名接受ICI治疗的NSCLC患者,中位随访时间分别为38.1个月和43.3个月。
- 研究使用全切片的苏木精-伊红染色图像开发了一种自动化的ML方法来计数肿瘤、基质和TIL细胞。
- 研究还分别评估了肿瘤突变负担(TMB)和程序性死亡配体-1(PD-L1)的表达,并通过病历审查确定了对ICI治疗的临床反应。
主要结果:
- 在多变量分析中,高水平的TILs(≥250个细胞/mm²)与两个队列中ICI反应独立相关。
- 在PD-L1阴性(<1%)亚组中,TILs水平在预测ICI反应方面的分类准确性优于TMB。
- 联合模型TILs/PD-L1或TMB/PD-L1在区分ICI反应者方面比单独使用PD-L1具有更高的特异性。
结论:
- TILs水平与ICI治疗反应强相关,并且可以以最低的额外成本轻松地纳入病理实验室的工作流程,可能增强精准治疗。
研究意义:
- 这项研究提供了一种新的方法来评估NSCLC患者对ICI治疗的潜在反应性,有助于改善患者的选择和治疗指导。
文章还讨论了ML在病理图像分析中的应用,TILs与临床参数和结果的关联,以及不同生物标志物在预测ICI反应中的相对重要性。此外,文章还指出了研究的局限性和未来的研究方向。
基线数据
表中列出了两个独立队列(发现队列和验证队列)在接受免疫检查点抑制剂(ICI)单药治疗的非小细胞肺癌(NSCLC)患者的基线特征。

-
患者人数:
- 发现队列包括446名患者。
- 验证队列包括239名患者。
-
治疗药物:
- 两个队列中大多数患者接受的ICI治疗药物是pembrolizumab(发现队列55%,验证队列53%)和nivolumab(发现队列37%,验证队列39%)。
- 少数患者接受了atezolizumab(发现队列6%,验证队列6%)或其他ICI药物(发现队列2%,验证队列2%)。
-
ICI治疗线数:
- 发现队列和验证队列中大约40%的患者接受的是一线ICI治疗,而大约60%的患者接受的是二线或以上的治疗。
-
年龄分布:
- 两个队列中大约一半的患者年龄小于66岁,另一半年龄66岁及以上。
-
性别分布:
- 发现队列中女性患者占56%,而验证队列中女性患者占41%,整体上女性患者占51%。
-
组织学发现:
- 大多数患者被诊断为肺腺癌(LUAD),在发现队列中占79%,在验证队列中占67%。
-
吸烟史:
- 大约87%的患者有吸烟史,13%的患者从未吸烟,吸烟状态未知的患者很少。
-
ECOG表现状态:
- 大多数患者(发现队列81%,验证队列82%)的ECOG表现状态为0-1,表示他们的日常生活能力较好。
-
样本来源:
- 发现队列中57%的样本为切除组织,而验证队列中只有20%,这表明验证队列中有更多患者可能处于疾病晚期。
-
肿瘤类型和组织类型:
- 发现队列中45%为原发肿瘤,53%为转移性肿瘤;57%为切除组织,43%为活检组织。
- 验证队列中51%为原发肿瘤,49%为转移性肿瘤;但切除组织样本较少,只有20%,活检组织样本占80%。
-
KRAS/EGFR基因突变状态:
- 发现队列中37%的患者KRAS基因突变,9%的患者EGFR基因突变,54%的患者KRAS/EGFR基因未检测到突变。
-
PD-L1表达水平:
- PD-L1表达水平分为三组:<1%(低表达)、1-49%(中表达)、≥50%(高表达)。发现队列中低表达占15%,中表达占33%,高表达占52%;验证队列中这些比例分别为27%、16%和36%。
-
TMB(肿瘤突变负担):
- 发现队列中51%的患者TMB小于10个突变/Mb,49%的患者TMB大于或等于10个突变/Mb。
这个表格提供了两个队列的详细基线特征,这些特征可能与患者对ICI治疗的反应和临床结果有关。通过比较两个队列的这些特征,研究人员可以更好地评估TILs评分方法的有效性,并探索可能影响治疗反应的其他因素。
图表分析
图1
Figure 1 展示了肿瘤浸润性淋巴细胞(TILs)在不同组织样本中的分布情况以及它们与临床结果(特别是无进展生存期,PFS)的关联。

A. TILs在不同组织样本中的分布:
- 该图显示了在发现队列和验证队列中,TILs在不同组织样本(如脑、肝、淋巴结、肺、胸膜、软组织等)的计数(每平方毫米的细胞数)。
- 通过Kruskal-Wallis检验,不同组织样本的TILs水平存在显著性差异(P < .001)。
- 这个图表明了TILs在不同类型的NSCLC患者肿瘤组织中的分布情况,这有助于了解肿瘤微环境中免疫细胞的浸润模式。了解这些分布模式对于评估肿瘤免疫原性及预测免疫治疗反应可能具有重要意义。
B. 根据PD-L1表达水平的TILs水平:
- 该图展示了不同PD-L1表达水平(通过肿瘤比例评分,TPS,来衡量)的TILs水平分布。
- 可以看到,随着PD-L1表达水平的增加,TILs的水平也有所增加,这表明PD-L1表达水平与TILs水平之间存在一定的相关性(P = .01,Kruskal-Wallis检验)。
- 此图显示了TILs水平与PD-L1表达水平之间的关系。由于PD-L1是免疫检查点抑制剂治疗的主要靶点,这种关联可能有助于理解PD-L1表达与肿瘤免疫微环境之间的相互作用,进而影响治疗策略的选择。
C. 发现队列的无进展生存期(PFS):
- 该图展示了在发现队列中,根据TILs水平(≥250 vs <250 TILs/mm²)分组的患者的PFS。
- 具有较高TILs水平的患者(≥250 TILs/mm²)的中位PFS显著长于TILs水平较低的患者(<250 TILs/mm²),风险比(HR)为0.74,95%置信区间(CI)为0.61-0.90,P值为.003。
- 这个图是研究中的主要发现之一,它展示了TILs水平与ICI治疗反应之间的直接关联。具有较高TILs水平的患者有更好的PFS,这表明TILs水平可能是预测ICI治疗效果的有用生物标志物。
D. 验证队列的无进展生存期(PFS):
- 类似地,该图展示了在验证队列中,根据TILs水平分组的患者的PFS。
- 与发现队列相似,具有较高TILs水平的患者(≥250 TILs/mm²)的中位PFS显著长于TILs水平较低的患者(<250 TILs/mm²),HR为0.47,95% CI为0.35-0.63,P值小于.001。
- 此图在独立的验证队列中复现了发现队列的发现,增强了TILs水平作为预测生物标志物的可信度。这进一步证实了TILs水平与ICI治疗反应之间的关联,并支持将TILs评估作为临床决策工具的潜在价值。
总体结论:
- 这些图表表明,TILs的水平不仅在不同组织样本中有所不同,而且与非小细胞肺癌患者接受免疫检查点抑制剂治疗后的PFS有显著的正相关性。即TILs水平越高,患者对ICI治疗的反应可能越好,PFS也越长。这些发现支持了TILs作为预测NSCLC患者对ICI治疗反应的潜在生物标志物的观点。
图2
Figure 2 提供了森林图(Forest Plots),这是一种用来展示多个研究或分析结果的图形方法,通常用于元分析或多变量分析中。
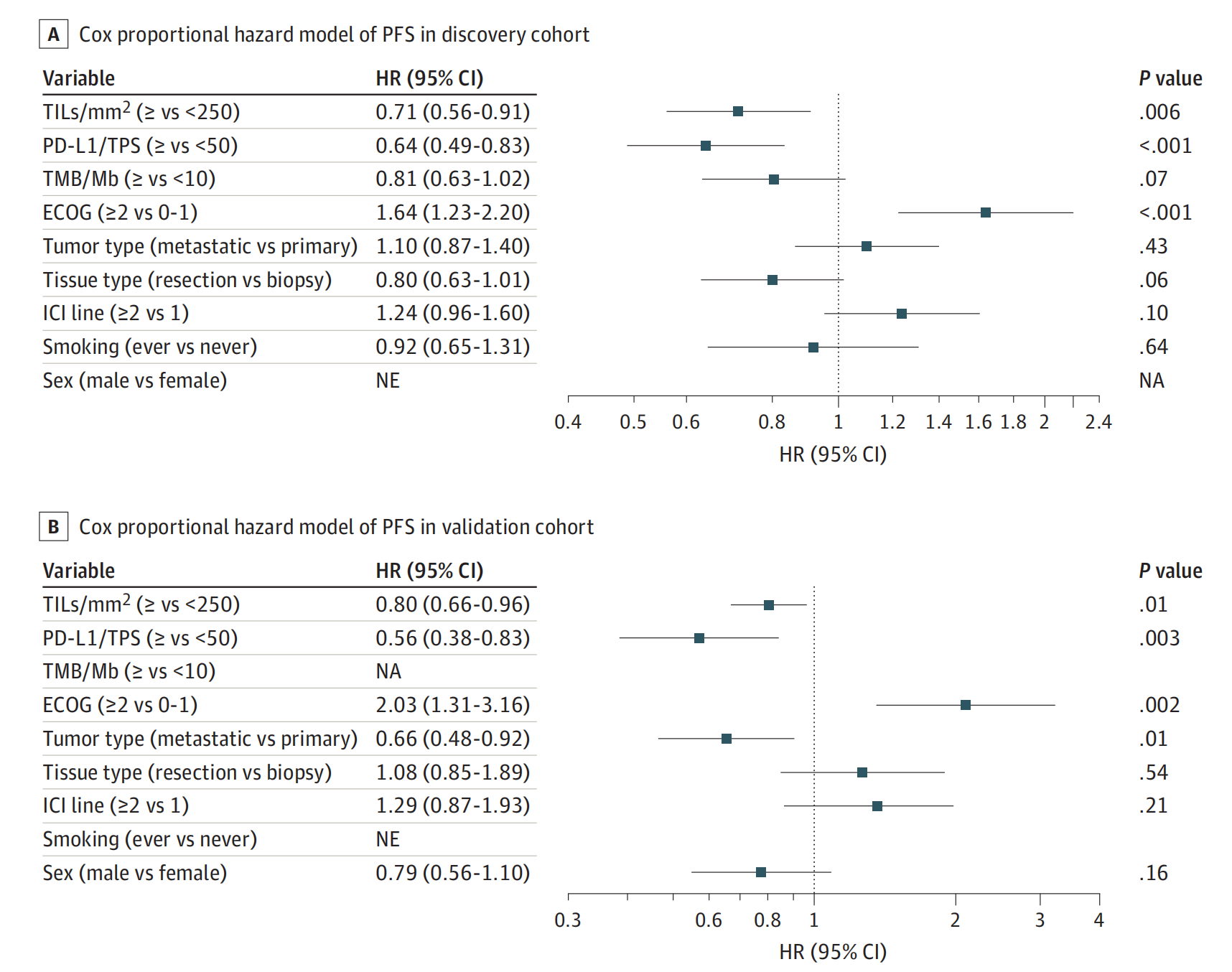
在这个特定的图表中,森林图展示了不同变量对非小细胞肺癌(NSCLC)患者在接受免疫检查点抑制剂(ICI)治疗后的无进展生存期(PFS)的影响。
-
变量的效应估计:
- 每个条形图代表一个变量的效应估计(通常是一个风险比,HR,Hazard Ratio)。
- 条形图的长度表示效应估计的置信区间(Confidence Interval,CI),条形图越长,置信区间越宽,表示估计的不确定性越大。
-
P值:
- 每个条形图旁边的P值表示该变量与PFS相关性的统计显著性。P值小于0.05通常被认为是统计显著的。
-
变量的分类:
- 变量根据其对PFS的影响被分类为不同的组,例如TILs/mm²(肿瘤浸润淋巴细胞每平方毫米的数量,分为≥250和<250两组)、ICI治疗线数(一线治疗与二线或以上治疗的比较)、性别、PD-L1表达水平、TMB水平等。
-
森林图的组成:
- 森林图通常由两部分组成:左侧的条形图和右侧的汇总效应估计(通常是一个点估计,例如HR的值)。
- 汇总效应估计下方的线表示无效应的参考线,即HR=1。
-
具体变量分析:
- TILs/mm²:高TILs水平(≥250)与PFS的改善显著相关。
- ICI治疗线数:二线或以上治疗与一线治疗相比,可能对PFS有不同的影响。
- 性别:男性与女性的PFS可能存在差异。
- PD-L1/TPS:高PD-L1表达水平(≥50%)与PFS的改善显著相关。
- TMB/Mb:高肿瘤突变负担(≥10 mu/Mb)与PFS的关系。
-
结论:
- 森林图为研究者提供了一个快速的视觉工具,用以评估不同变量对PFS的影响,并识别哪些变量可能是预测NSCLC患者对ICI治疗反应的潜在生物标志物。
森林图是多变量生存分析的一部分,它允许研究者同时考虑多个变量对临床结果的影响,并评估它们在统计上的独立贡献。在这项研究中,森林图强调了TILs水平作为预测ICI治疗反应的一个重要因素,并且可能有助于指导未来的治疗策略。
图3
Figure 3 展示了不同生物标志物组合模型对于预测免疫检查点抑制剂(ICI)治疗反应的效果。

A. 单一生物标志物与组合生物标志物的预测能力:
- 该图通过接收者操作特征曲线(ROC)下面积(AUC)来展示单一生物标志物(PD-L1、TILs、TMB)以及它们的组合(PD-L1/TILs、PD-L1/TMB)在预测ICI治疗反应方面的能力。
- AUC值越接近1,表示预测模型的准确性越高。在这个案例中,PD-L1单独使用时的AUC为0.68,而当PD-L1与TILs或TMB结合时,AUC分别提高到0.68和0.70,表明组合模型在预测治疗反应方面具有更高的准确性。
B. 根据PD-L1表达和TILs水平的组合模型的PFS:
- 该图展示了根据PD-L1表达水平(<50% vs ≥50%)和TILs水平(<250 vs ≥250 cells/mm²)的不同组合分组的患者PFS。
- 图表中的四组分别为:低PD-L1/低TILs、低PD-L1/高TILs、高PD-L1/低TILs、高PD-L1/高TILs。
- 每组的中位PFS(mPFS)和客观反应率(ORR)被列出,显示不同组合对患者PFS和治疗反应的影响。
C. 根据PD-L1表达和TMB的组合模型的PFS:
- 类似于B部分,这个图根据PD-L1表达水平和TMB水平(<10 vs ≥10 mu/Mb)的不同组合分组,展示了患者的PFS。
- 同样列出了每组的mPFS和ORR,以展示不同组合对PFS和治疗反应的影响。
总体结论:
- Figure 3 强调了结合多个生物标志物可以提高预测ICI治疗反应的准确性。特别是,当PD-L1与TILs或TMB结合时,可以更精确地区分对ICI治疗有反应和无反应的患者。
- 这些组合模型可能有助于为NSCLC患者提供更个性化的治疗策略,通过识别最有可能从特定治疗中获益的患者群体。
这些图表对于临床实践具有重要意义,因为它们提供了一种方法来优化患者的治疗选择,通过预测哪些患者更有可能从ICI治疗中获益,从而可能提高治疗效果并减少不必要的副作用。
图4
Figure 4 专注于PD-L1阴性亚组的非小细胞肺癌(NSCLC)患者,比较了肿瘤浸润性淋巴细胞(TILs)水平和肿瘤突变负担(TMB)水平对免疫检查点抑制剂(ICI)治疗反应的预测能力。

A. TILs与TMB预测ICI反应的模型性能:
- 这部分通过ROC曲线下面积(AUC)来比较TILs和TMB在预测ICI治疗反应方面的表现。
- AUC值越高,表示预测模型的准确性越高。在这个案例中,TILs的AUC高于TMB,表明在PD-L1阴性患者中,TILs可能是一个更有效的预测指标。
B. TILs水平对PFS的影响:
- 该图展示了PD-L1阴性亚组中不同TILs水平(≥250 vs <250 TILs/mm²)对患者无进展生存期(PFS)的影响。
- 具有较高TILs水平的患者似乎有更长的PFS,这通过风险比(HR)和95%置信区间(CI)以及P值来量化。
C. TMB水平对PFS的影响:
- 这部分分析了PD-L1阴性亚组中不同TMB水平(≥10 vs <10 mu/Mb)对PFS的影响。
- 该图显示了TMB水平与PFS之间的关系,但根据P值,这种关系可能不具有统计学意义。
D. 验证队列中TILs水平对PFS的影响:
- 这部分在独立的验证队列中复现了TILs水平对PFS影响的分析,增强了发现队列中观察到的关联的可信度。
总体结论:
- Figure 4 强调了在PD-L1阴性NSCLC患者中,TILs水平可能是一个比TMB更有效的预测ICI治疗反应的生物标志物。
- 在PD-L1阴性患者群体中,高TILs水平与更好的PFS相关,这可能有助于识别那些更有可能从免疫治疗中获益的患者。
这些图表对于临床决策具有重要意义,因为它们提供了一种方法来识别PD-L1阴性患者中可能对ICI治疗有反应的患者群体。这有助于为这一患者群体提供更个性化的治疗选择,可能提高治疗效果并减少不必要的副作用。
三、PathoRiCH:一种新型的基于组织病理图像的卵巢癌治疗反应预测工具

一作&通讯
| 角色 | 姓名 | 单位(中文) |
|---|---|---|
| 第一作者 | Byungsoo Ahn | 延世大学医学院病理学系,首尔,韩国 |
| 第一作者 | Damin Moon | JLK Inc. 人工智能研究中心,首尔,韩国 |
| 第一作者 | Hyun-Soo Kim | 三星医疗中心病理学和转化基因组学系,成均馆大学医学院,首尔,韩国 |
| 通讯作者 | Eunhyang Park | 延世大学医学院病理学系,首尔,韩国 |
文献概述
这篇文章报道了一种新型的基于深度学习的组织病理图像分类器PathoRiCH,它能够预测高级别浆液性卵巢癌患者对铂基治疗的反应,并通过结合分子生物标志物为患者提供更精确的风险分层。
-
研究背景:HGSOC是最常见的妇科恶性肿瘤,通常在初次诊断时已处于晚期,预后较差。铂基化疗是HGSOC的标准治疗,但患者对其的反应各不相同。目前缺乏能够快速预测患者对铂基治疗反应的生物标志物。
-
PathoRiCH开发:研究者开发了PathoRiCH,这是一种基于组织病理图像的分类器,通过深度学习技术训练而成。PathoRiCH在内部队列(n=394)上进行训练,并在两个独立的外部队列(n=284和n=136)上进行验证。
-
研究结果:PathoRiCH预测的对铂基治疗反应良好和反应差的患者组在所有三个队列中显示出显著不同的无铂间期(PFI)。结合PathoRiCH和分子生物标志物可以为患者风险分层提供更强大的工具。通过可视化和转录组分析解释了PathoRiCH的决策过程,增强了模型决策的可靠性。
-
模型性能:PathoRiCH在预测性能上优于当前的分子生物标志物。在内部和外部验证队列中,PathoRiCH预测的有利和不利反应组的PFI有显著差异。
-
风险分层:PathoRiCH结合BRCA突变和同源重组缺陷(HRD)状态可以进一步细分患者,实现更精确的风险分层。
-
独立预后因素:在外部验证队列中,PathoRiCH被识别为最强的独立预后因素。
-
可视化分析:研究者生成了关注图,展示了PathoRiCH预测有利和不利组的决策依据,并通过聚类分析识别了与治疗反应相关的组织学特征。
-
转录组分析:对预测结果正确的患者组和预测结果错误的患者组进行了转录组分析,发现了与免疫反应和细胞外基质相关的基因表达差异。
-
BRCA突变和HRD状态预测:研究还训练了用于预测BRCA突变状态和HRD状态的模型,但这些模型的表现并不理想。
-
讨论:PathoRiCH作为一种基于组织病理图像的深度学习模型,展示了在预测HGSOC患者PFI方面的潜力。该模型可以作为现有分子生物标志物的补充,为临床诊断实践提供风险分层信息。
-
方法和数据:研究使用了来自不同医院的患者数据,包括临床病理特征、BRCA突变和HRD状态。使用了多种图像处理和机器学习技术来开发和验证PathoRiCH模型。
-
结论:PathoRiCH有潜力改变HGSOC的当前诊断流程,并指导妇科肿瘤学家选择初步和维持治疗、规划监测频率和向患者咨询临床试验。
基线数据
表1提供了三个不同队列(SEV、TCGA和SMC)中高级别浆液性卵巢癌(HGSOC)患者的临床病理特征的汇总。

- 患者数量:SEV队列有394名患者,TCGA队列有284名,SMC队列有136名。
- 全切片图像(WSIs)数量:SEV队列有754个WSIs,TCGA队列有516个,SMC队列有136个。
- 年龄:SEV队列患者的平均年龄为53.9岁,TCGA队列为59.8岁,SMC队列为56.9岁,显示不同队列间存在年龄差异。
- 癌症分期:
- SEV队列中没有I期和II期患者,大多数为III期(54.3%)和IV期(45.7%)。
- TCGA队列包含少数I期(4.2%)和II期(8.5%)患者,大多数为III期(79.9%)。
- SMC队列中大多数患者为III期(56.6%),其次是IV期(24.3%),也有少数I期(8.8%)和II期(10.3%)患者。
- BRCA突变状态:
- SEV队列中16.5%的患者为突变型,37.6%为野生型,45.9%未知。
- TCGA队列中6.7%为突变型,93.3%为野生型,没有未知情况。
- SMC队列中20.6%为突变型,78.7%为野生型,0.7%未知。
- 同源重组缺陷(HRD)状态:表中列出了三种不同的HRD状态评估方法,但大多数情况下,HRD状态未知或未评估。
- 铂治疗反应组:
- “铂抵抗”(PFI ≤ 6个月)的患者比例在SEV队列中为18.5%,TCGA队列中为4.2%,SMC队列中为4.4%。
- “部分铂敏感”(PFI 6–12个月)的患者比例在SEV队列中为15.0%,TCGA队列中为16.5%,SMC队列中为23.5%。
- “铂敏感”(PFI 12–24个月)的患者比例在SEV队列中为21.6%,TCGA队列中为45.1%,SMC队列中为1.5%。
- “非常铂敏感”(PFI > 24个月)的患者比例在SEV队列中为44.9%,TCGA队列中为34.2%,SMC队列中为70.6%。
这些数据为研究者提供了不同队列中HGSOC患者的详细特征,有助于分析PathoRiCH分类器在不同患者群体中的预测性能和临床应用的潜在价值。
图表分析
图1
图1提供了研究中使用的多实例学习(MIL)模型的概述。

-
图像块提取:从全切片图像(WSIs)中提取不同放大倍数(5×和20×)的图像块。这些图像块是构成WSIs的基本单元。
-
自动化癌症分割:使用自动化癌症分割模型处理这些图像块,目的是排除那些不含癌细胞的图像块。这一步骤是为了确保后续的深度学习模型只处理含有癌症特征的图像数据。
-
对比自监督学习算法:经过癌症分割的图像块被送入对比自监督学习算法中(图中蓝色箭头路径)。这种算法通过比较不同增强视图的同一数据示例来学习图像的表示。
-
全组织学习:或者,所有图像块,包括不含癌细胞的图像块,也可以直接送入自监督学习算法中,以包含WSIs中的所有组织(图中红色箭头路径)。这可能有助于模型学习更全面的组织特征。
-
多实例学习方法:对于单一放大倍数和多尺度放大倍数设置(5×、20×和两者结合),分别使用不同的MIL方法。这样,一共生成了六种不同的MIL模型。
-
特征金字塔:对于多尺度MIL模型,通过连接不同尺度WSIs的嵌入(embeddings),形成特征金字塔,以训练MIL聚合器。这种方法可以整合不同尺度的信息,可能有助于模型更好地理解和分类图像特征。
图1显示了一个复杂的深度学习模型设计,它结合了癌症分割、自监督学习和多实例学习,旨在从组织病理图像中自动发现和学习癌症特征,以预测HGSOC患者对铂基治疗的反应。这种设计允许模型从不同尺度学习特征,并可能提高预测的准确性和鲁棒性。
图2
图2展示了使用Kaplan-Meier生存分析方法对PathoRiCH模型预测结果的验证,特别是在癌症分割区域20倍放大的多实例学习模型中。

a. 内部验证(SEV队列):
- PathoRiCH模型预测的有利和不利两组在无铂间期(PFI)和总生存期(OS)上显示出显著差异。
- PFI的p值为4.17E-05,表明预测的两组之间在PFI上有极其显著的统计学差异。
- OS的p值为8.73E-05,同样表明预测的两组之间在OS上有极其显著的统计学差异。
b. TCGA外部队列验证:
- 在TCGA外部队列中,PathoRiCH模型同样显示出在PFI和OS上的显著患者分层。
- PFI的p值为0.032,虽然比内部验证的p值大,但仍然表示两组之间在PFI上有统计学显著差异。
- OS的p值为1.06E-09,这是一个极其小的p值,表明预测的两组之间在OS上有极其显著的统计学差异。
c. SMC外部队列验证:
- SMC外部队列中,PathoRiCH模型在PFI上也显示出显著的患者分层,p值为0.030,表明两组之间在PFI上有统计学显著差异。
- 然而,在OS上,p值为0.54,这表明预测的两组之间在OS上没有达到统计学显著差异。
总体分析:
- Kaplan-Meier生存曲线通常用于展示患者生存时间的分布情况,其中p值用于评估两组或多组之间的生存差异是否具有统计学意义。
- 在所有验证队列中,PathoRiCH模型在PFI上均显示出显著的预测能力,这表明模型能够区分对铂基治疗反应不同的患者群体。
- 对于OS,内部验证和TCGA外部队列中模型显示出良好的预测能力,但SMC队列中没有达到统计学显著性,这可能表明需要更多的样本或进一步的模型调整来提高预测的准确性。
图2的结果强调了PathoRiCH模型在预测HGSOC患者对铂基治疗反应方面的潜力,尤其是在PFI上,同时也指出了在不同患者群体中模型性能可能存在的差异。
图3
图3提供了在TCGA外部队列中,结合PathoRiCH、BRCA和HRD状态对患者进行分层的Kaplan-Meier生存分析和真正的无铂间期(PFI)组的分布情况的分析。

a. Kaplan-Meier生存曲线图:
- 根据PathoRiCH、BRCA和HRD的综合结果,患者被分为不同的组,并且这些组在PFI和OS上显示出显著的差异。
- PFI的p值为1.07E-05,OS的p值为3.30E-16,这表明结合这些因素可以显著区分患者的治疗反应和生存结果。
- 特别是,BRCA/HRD阳性的有利组显示出最有利的PFI,而BRCA/HRD阳性的不利组和BRCA/HRD阴性的不利组显示出最差的PFI。

b. PFI组的分布:
- 四个PFI组被定义为:铂抵抗(PFI ≤ 6个月)、部分铂抵抗(6–12个月)、铂敏感(12–24个月)和非常铂敏感(>24个月)。
- 通过结合PathoRiCH、BRCA和HRD的结果显示了四个PFI组的显著不同的分布,p值为0.001。
- 条形图中的彩色条表示每个结果组预测的百分比(蓝色代表有利,红色代表不利),每个条形图内的数值显示每个类别的案例数量。
总体分析:
- 结合PathoRiCH、BRCA和HRD状态的分层方法提供了一种强大的工具,可以显著区分HGSOC患者对铂基治疗的反应和生存结果。
- 该分析表明,BRCA/HRD阳性的患者如果被PathoRiCH预测为有利组,可能会有更长的PFI,这可能有助于指导临床决策,例如选择PARP抑制剂治疗。
- 相反,BRCA/HRD阳性或阴性的不利组可能会有更短的PFI,这可能表明这些患者对铂基治疗抵抗,需要考虑其他治疗方案或临床试验。
- 该图还强调了使用多参数方法可以提供比单一生物标志物更细致的患者分层,有助于实现更个性化的治疗策略。
图3的结果进一步证明了PathoRiCH作为一种新型的分类工具,与现有的分子生物标志物相结合,可以提供更全面的预后信息,并可能改善HGSOC患者的治疗管理。
图4
图4展示了在TCGA和SMC外部队列中进行的多变量Cox回归分析的结果,这种分析是一种用来评估多个预后因素对生存时间影响的统计方法。
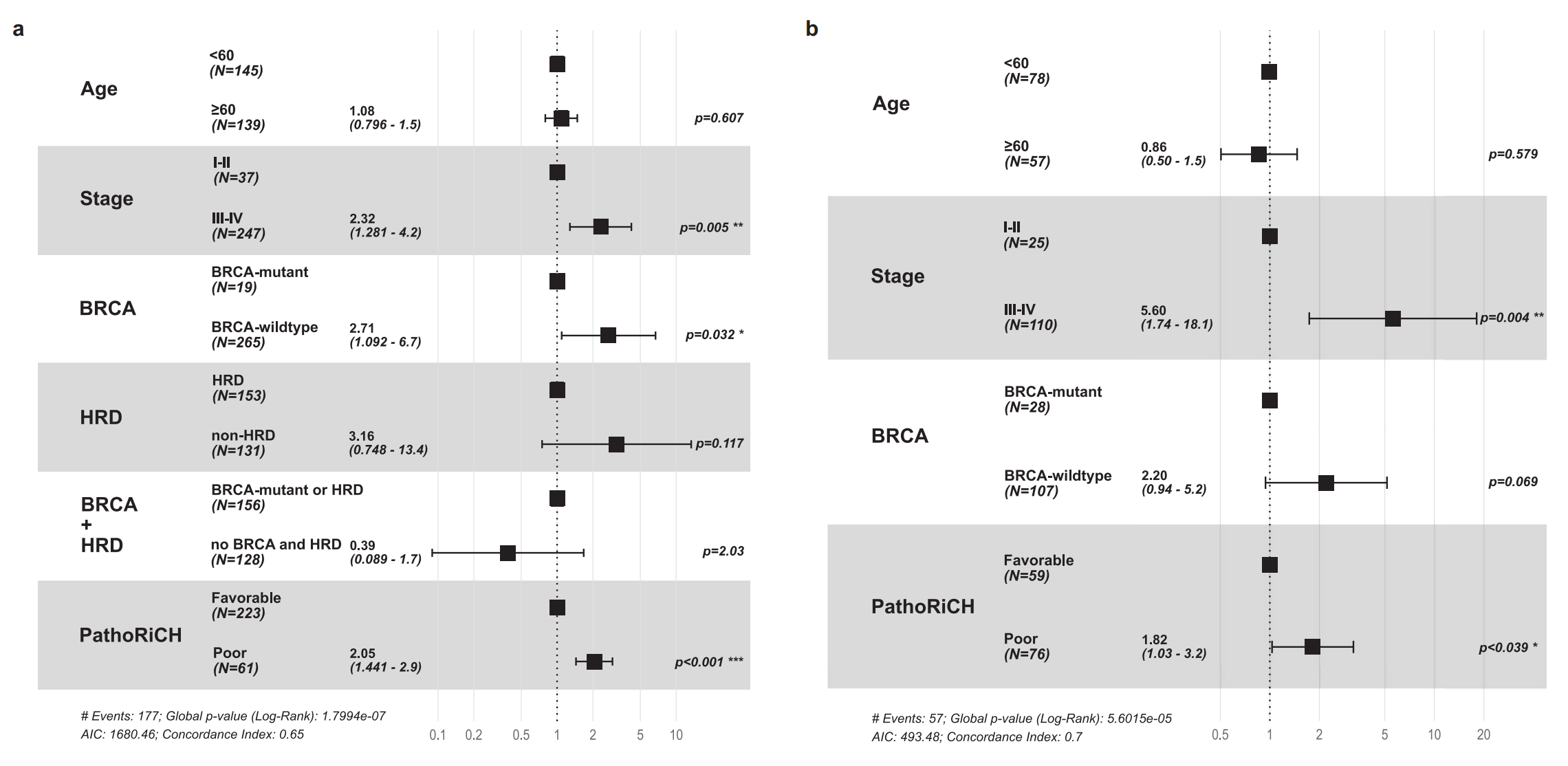
a. TCGA队列分析:
- 在TCGA队列中,多变量Cox回归分析包括了六个变量:年龄、FIGO分期、BRCA突变状态、HRD状态、BRCA和HRD联合状态以及PathoRiCH预测结果。
- PathoRiCH预测结果是最强的独立预后因素,p值为6.57E-05,这表明PathoRiCH预测与患者预后有显著相关性。
- FIGO分期作为第二个最强的预后因素,p值为0.005,说明癌症的分期也是影响患者生存的重要因素。
b. SMC队列分析:
- 在SMC队列中,FIGO分期(p = 0.004)和PathoRiCH预测(p = 0.039)显著地作为独立的预后因素。
- 值得注意的是,在SMC队列中,PathoRiCH预测的p值为0.039,这与TCGA队列的结果相比,表明PathoRiCH在SMC队列中的预测能力可能较弱或不显著。
误差棒:
- 图中的数据以带有误差棒的形式呈现,误差棒代表了95%置信区间。这表明了估计值的不确定性范围,误差棒越短,表示估计越精确。
总体分析:
- PathoRiCH在TCGA队列中显示出作为独立预后因素的显著性,但在SMC队列中却没有达到统计学显著性,这可能表明PathoRiCH的预测能力在不同患者群体中可能存在差异。
- FIGO分期在两个队列中都显示出与患者预后显著相关,这强调了癌症分期对于预后判断的重要性。
- 不同队列中BRCA突变状态的显著性不同,可能与队列的遗传背景或其他未测量的混杂因素有关。
- 多变量Cox回归分析的结果表明,除了PathoRiCH预测外,传统的临床和分子特征仍然是卵巢癌预后评估中不可或缺的因素。
图4的数据强调了在临床决策中结合传统预后因素和新型生物标志物的重要性,并提示PathoRiCH可能作为一个有前景的工具,但其在不同患者群体中的适用性需要进一步的验证和研究。
四、AI分析三阴性乳腺癌患者的三级淋巴结构和肿瘤芽,提升患者生存预测的准确性

一作&通讯
| 角色 | 姓名 | 单位名称(中文) | 单位名称(英文) |
|---|---|---|---|
| 第一作者 | 侯旭鹏 | 天津医科大学肿瘤医院乳腺肿瘤科 | Department of Breast Cancer, Tianjin Medical University Cancer Institute and Hospital, Tianjin, China |
| 第一作者 | 李学阳 | 天津医科大学肿瘤医院乳腺肿瘤科 | Department of Breast Cancer, Tianjin Medical University Cancer Institute and Hospital, Tianjin, China |
| 第一作者 | 韩云伟 | 天津医科大学 | Tianjin Medical University, Tianjin, China |
| 通讯作者 | 刘静 | 天津医科大学肿瘤医院乳腺肿瘤预防与治疗重点实验室 | Key Laboratory of Breast Cancer Prevention and Therapy, Tianjin Medical University, Ministry of Education, Tianjin, China |
| 通讯作者 | 刘颖 | 上海交通大学医学院附属上海第九人民医院整形外科 | Department of Plastic and Reconstructive Surgery, Shanghai Ninth People’s Hospital Shanghai Jiao Tong University School of Medicine, Shanghai, China |
| 通讯作者 | 郭晓静 | 天津医科大学肿瘤医院肿瘤预防与治疗国家临床研究中心 | National Clinical Research Center for Cancer, Key Laboratory of Cancer Prevention and Therapy, Tianjin’s Clinical Research Center for Cancer, Tianjin, China |
文献概述
这篇文章利用人工智能技术,通过分析三阴性乳腺癌患者的三级淋巴结构和肿瘤芽,建立了一个新的预后预测模型,提高了对患者生存预测的准确性。
TNBC是一种高度异质性和临床侵袭性的疾病,目前的治疗主要基于肿瘤-淋巴结-转移(TNM)分类系统。然而,由于TNBC的高度异质性,相同TNM分期的患者可能会有不同的临床预后,因此迫切需要开发新的模型来预测TNBC患者的临床预后。
研究者们利用AI技术,通过对组织学染色和免疫组化染色的图像进行分析,评估了三级淋巴结构(Tertiary lymphoid structures, TLSs)和肿瘤芽(Tumor budding, TB)的浸润水平。研究发现,TLS和TB与TNBC患者的预后显著相关,但尚未建立综合TLS-TB特征来预测他们的生存。本研究的目的是使用基于AI的分析方法研究TLS/TB比例与TNBC患者临床结果之间的关系。
研究包括了一个独立的回顾性训练队列和一个验证队列的TNBC患者。使用H&E染色和免疫组化染色评估TLS和TB的浸润水平,并使用多重免疫荧光技术确定TLS内的不同细胞亚型。然后,研究者建立了一个列线图模型,进行了校准曲线分析,并使用R软件执行了决策曲线分析。
研究结果显示,在训练和验证队列中,作者建立的抗肿瘤/促肿瘤模型显示TLS/TB指数与TNBC患者的总生存期(OS)和无复发生存期(RFS)呈正相关。特别是,TLS中CD8阳性T细胞、CD45RO阳性T细胞或CD20阳性B细胞比例高的患者经历了改善的OS和RFS。此外,研究者基于TLS/TB指数开发了一个全面的TLS-TB特征列线图。这个新模型在预测TNBC患者的OS和RFS方面优于经典的TNM分期系统。
结论是,通过综合AI分析和机器学习工作流程,建立了一种预测TNBC患者预后的新策略。TLS/TB指数被确定为TNBC的独立预后因素。基于列线图的TLS-TB特征将有助于提高预测TNBC患者预后的准确性。
基线数据
表1提供了三阴性乳腺癌(TNBC)患者在回顾性训练队列和验证队列中的临床病理特征。

-
年龄分布:
- 在训练队列(118名患者)中,56.8%的患者年龄小于或等于55岁,而43.2%的患者年龄大于55岁。
- 在验证队列(130名患者)中,42.3%的患者年龄小于或等于55岁,57.7%的患者年龄大于55岁。
-
肿瘤大小:
- 训练队列中,60.2%的肿瘤直径小于或等于2厘米,39.8%的肿瘤直径大于2厘米。
- 验证队列中,肿瘤大小的分布与训练队列相似,60.8%的肿瘤直径小于或等于2厘米,39.2%的肿瘤直径大于2厘米。
-
组织学分级:
- 训练队列中,40.7%的肿瘤为低分级(1, 1-2, 和 2),59.3%为高分级(2-3 和 3)。
- 验证队列中,55.4%的肿瘤为低分级,44.6%为高分级。
-
淋巴结转移:
- 训练队列中,39.8%的患者存在淋巴结转移,60.2%的患者无淋巴结转移。
- 验证队列中,48.5%的患者存在淋巴结转移,51.5%的患者无淋巴结转移。
-
TNM分期:
- 训练队列中,51.7%的肿瘤为低分期(IA, IB, 和 IIA),48.3%为高分期(IIB, IIIA, IIIB, 和 IIIC)。
- 验证队列中,62.3%的肿瘤为低分期,37.7%为高分期。
-
Ki67阳性肿瘤细胞百分比:
- 训练队列中,48.3%的患者Ki67表达低于或等于30%,51.7%的患者Ki67表达高于30%。
- 验证队列中,48.5%的患者Ki67表达低于或等于30%,51.5%的患者Ki67表达高于30%。
-
TLS密度(每视野计数,Counts Per Field, CPF):
- 训练队列中,42.4%的肿瘤TLS密度低(CPF ≤2),41.4%的肿瘤TLS密度高(CPF >2)。
- 验证队列中,50.8%的肿瘤TLS密度低,49.2%的肿瘤TLS密度高。
-
TB密度:
- 训练队列中,53.4%的肿瘤TB密度低(CPF ≤15.06),46.6%的肿瘤TB密度高(CPF >15.06)。
- 验证队列中,54.6%的肿瘤TB密度低,45.4%的肿瘤TB密度高。
这些数据表明,两个队列在临床病理特征上具有可比性,为研究提供了一致的基线,有助于验证研究结果的可靠性。此外,表中的数据也反映了TNBC的异质性,不同患者的肿瘤特征存在显著差异。
图表分析
图1
图1展示了人工智能(AI)在自动识别三阴性乳腺癌(TNBC)组织中的三级淋巴结构(TLS)和肿瘤芽(TB)方面的应用。
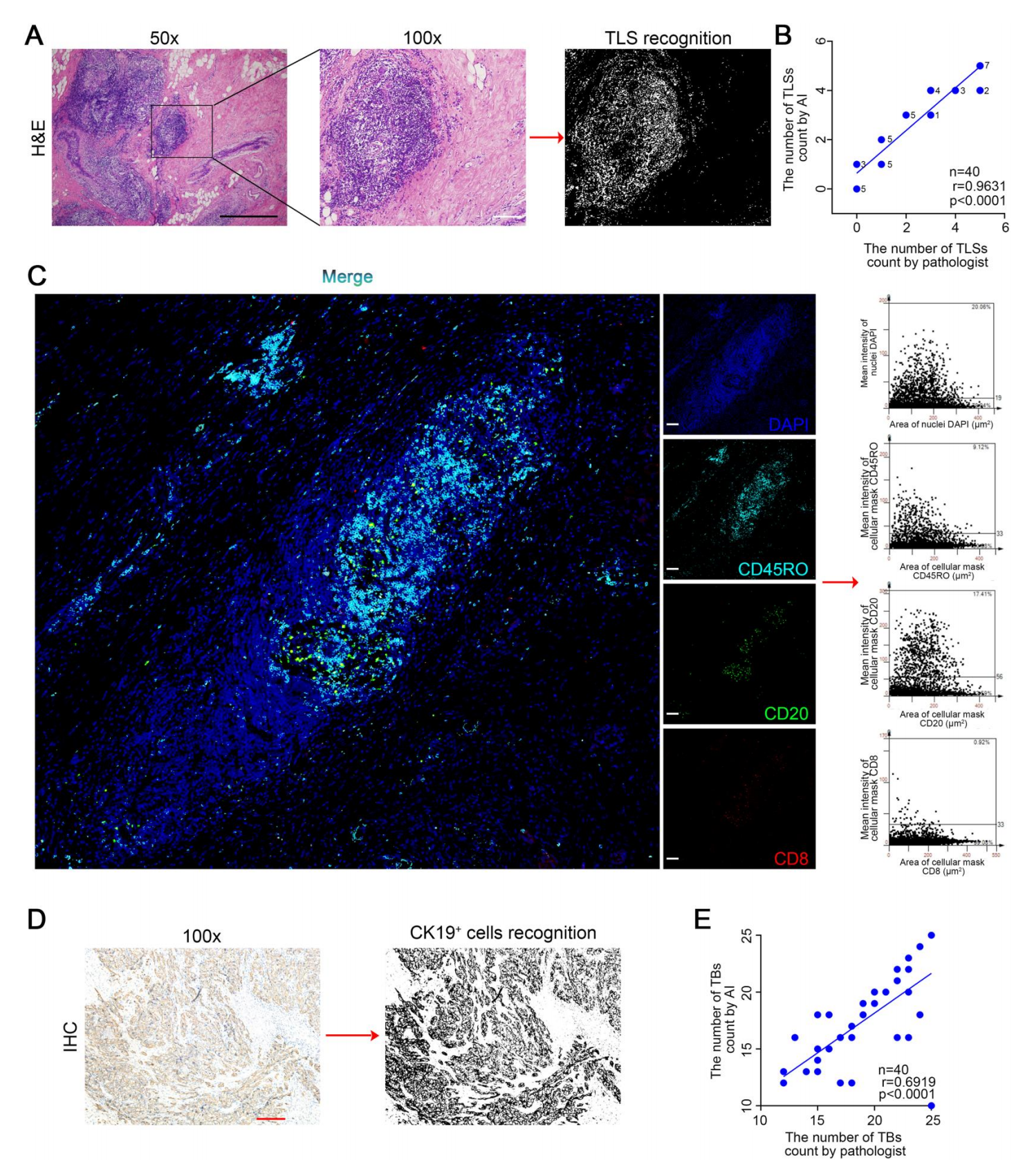
A. H&E染色图像的TLS识别:
- 展示了TNBC组织中TLS的代表性H&E染色图像,比例尺为200微米。
- 右侧图像显示了AI识别出的TLS。
B. H&E染色评估的一致性比较:
- 对比了经验丰富的病理学家和机器学习在H&E染色评估结果之间的一致性。
- 使用Spearman相关性系数进行了统计分析,得出了一致性的程度。
C. 多重免疫荧光(mIHC)图像:
- 展示了TNBC组织的代表性mIHC图像,其中包括CD45RO阳性T细胞(青色)、CD8阳性T细胞(绿色)、CD20阳性B细胞(红色)和核(蓝色),比例尺为100微米。
- 这些图像帮助识别和区分TLS中的不同免疫细胞类型。
D. CK19的IHC图像:
- 左侧展示了CK19的IHC图像,用于识别TNBC组织中的肿瘤细胞,比例尺为100微米。
- 右侧图像显示了AI根据CK19染色识别出的阳性细胞。
E. IHC评估的一致性比较:
- 对比了经验丰富的病理学家和机器学习在IHC评估结果之间的一致性,特别是针对CK19阳性细胞的识别。
- 同样使用了Spearman相关性系数来评估一致性。
注意:
CK19是细胞角蛋白19,常用于肿瘤细胞的标记。DAPI是4’,6-二脲基-2-苯基吲哚,一种荧光染料,常用于标记细胞核。IHC是免疫组化,用于检测组织中的特定蛋白质。mIHC是多重免疫组化,可以同时检测多种不同的标记物。TB是肿瘤芽,是肿瘤侵袭和转移的指标之一。TLS是三级淋巴结构,与抗肿瘤免疫反应相关。TNBC是三阴性乳腺癌,一种特殊类型的乳腺癌,缺乏雌激素受体、孕酮受体和HER2的表达。
图2
图2 探讨了三级淋巴结构(Tertiary Lymphoid Structures, TLS)和肿瘤芽(Tumor Buddings, TB)的密度与三阴性乳腺癌(Triple-Negative Breast Cancer, TNBC)患者临床结果之间的相关性,以及TLS和TB密度之间的关系。

A. 高密度和低密度TLS的H&E染色图像:
- 展示了高密度和低密度TLS的代表性H&E染色图像,比例尺为100微米,以直观显示TLS在TNBC组织中的分布情况。
B. 不同TLS密度组别的患者总生存期(OS)和无复发生存期(RFS):
- 根据TLS密度将回顾性训练队列中患者分为不同组别,并展示了每组的OS和RFS情况,以评估TLS密度与患者生存期的相关性。
C. 验证队列中不同TLS密度组别的患者OS和RFS:
- 类似于B部分,但数据来自回顾性验证队列,用以验证TLS密度与患者生存期相关性的结果的一致性。

D. 高密度和低密度TB的IHC染色图像:
- 展示了高密度和低密度TB的代表性IHC染色图像,比例尺为100微米,以直观显示TB在TNBC组织中的分布情况。
E. 不同TB密度组别的患者OS和RFS:
- 根据TB密度将回顾性训练队列中患者分为不同组别,并展示了每组的OS和RFS情况,以评估TB密度与患者生存期的相关性。
F. 验证队列中不同TB密度组别的患者OS和RFS:
- 类似于E部分,但数据来自回顾性验证队列,用以验证TB密度与患者生存期相关性的结果的一致性。

G. 训练队列中TB IHC染色与TLS H&E染色的Spearman相关性:
- 评估了训练队列中TB的IHC染色结果与TLS的H&E染色结果之间的一致性,并使用Spearman相关性系数进行了统计分析。
H. 验证队列中TB IHC染色与TLS H&E染色的Spearman相关性:
- 类似于G部分,但数据来自验证队列,用以验证TB和TLS密度之间相关性的结果的一致性。
注意:
- H&E表示苏木精-伊红染色
- IHC表示免疫组化
- OS表示总生存期
- RFS表示无复发生存期
- TBs表示肿瘤芽
- TLSs表示三级淋巴结构
通过这些分析,研究者能够探索TLS和TB在TNBC中的分布特征及其与患者临床结果之间的潜在联系。
表2
表2展示了三级淋巴结构(TLS)指数、肿瘤芽(TB)指数以及TLS/TB指数与初诊回顾性队列(N=118)中的临床病理特征之间的相关性。

-
年龄:
- 分为两个年龄段:≤55岁和>55岁。TLS指数在两个年龄段之间没有显著差异(Spearman r = -0.013,p = .883),而TB指数在>55岁的患者中较高(Spearman r = -0.164,p = .076),但未达到统计学显著性。TLS/TB指数在两个年龄段之间也没有显著差异(p = .987)。
-
肿瘤大小:
- 肿瘤分为≤2厘米和>2厘米两组。TLS指数在肿瘤较大患者中较低(Spearman r = -0.599,p < .000a),表明TLS密度与肿瘤大小负相关。TB指数在肿瘤较大患者中较高(Spearman r = 0.420,p < .000a),表明TB密度与肿瘤大小正相关。TLS/TB指数同样显示肿瘤较大的患者有更低的TLS/TB比值(Spearman r = -0.653,p < .000)。
-
组织学分级:
- 分为1, 1-2, 和2级(低分级)以及2-3和3级(高分级)。TLS指数在低分级肿瘤患者中较高(Spearman r = -0.291,p = .002a),而TB指数在高分级肿瘤患者中较高(Spearman r = 0.225,p = .006a)。TLS/TB指数同样在高分级肿瘤患者中较低(Spearman r = -0.339,p < .000a)。
-
淋巴结转移:
- 分为有无淋巴结转移两组。TLS指数在无淋巴结转移的患者中较高(Spearman r = -0.558,p < .000a),而TB指数在有淋巴结转移的患者中较高(Spearman r = 0.475,p < .000a)。TLS/TB指数在无淋巴结转移的患者中较高(Spearman r = -0.678,p < .000a)。
-
TNM分期:
- 分为IA, IB, 和IIA期(低分期)和IIB, IIIA, IIIB, 和IIIC期(高分期)。TLS指数在低分期患者中较高(Spearman r = -0.750,p < .000a),TB指数在高分期患者中较高(Spearman r = 0.559,p < .000a),TLS/TB指数在低分期患者中较高(Spearman r = -0.834,p < .000a)。
-
Ki67阳性肿瘤细胞百分比:
- 分为≤30%和>30%两组。TLS指数在Ki67低表达的患者中较高(Spearman r = -0.417,p < .000a),TB指数在Ki67高表达的患者中较高(Spearman r = 0.325,p < .000a),TLS/TB指数在Ki67低表达的患者中较高(Spearman r = -0.513,p < .000a)。
表2中的"p < .000"表示统计学上的显著性差异。这些数据表明TLS指数与较好的预后特征相关,如较小的肿瘤、较低的组织学分级、无淋巴结转移和较低的TNM分期。相反,TB指数与较差的预后特征相关。TLS/TB指数结合了这两个因素,提供了一个评估TNBC患者预后的有用指标。
图3
图3 探讨了TLS/TB指数与临床结果之间的相关性,包括总生存期(OS)和无复发生存期(RFS)。

A. 不同TLS/TB指数的代表性H&E染色和IHC图像:
- 左侧展示了高TLS/TB指数的H&E染色图像,右侧展示了IHC图像,用于展示TLS和TB在TNBC组织中的分布情况。
- 这些图像为观察者提供了不同TLS/TB指数水平下的组织学特征的视觉参考。
B. 回顾性训练队列中不同TLS/TB指数组别的患者OS和RFS:
- 根据TLS/TB指数将回顾性训练队列中患者分为高低两组,并展示了每组的OS和RFS情况。
- 通常预期,较高的TLS/TB指数(表示较多的TLS和/或较少的TB)与较好的OS和RFS相关。
C. 回顾性验证队列中不同TLS/TB指数组别的患者OS和RFS:
- 类似于B部分,但数据来自回顾性验证队列,用以验证TLS/TB指数与患者生存期相关性的结果的一致性。
注意:
- IHC代表免疫组化,用于检测特定蛋白质的存在和分布。
- OS代表总生存期,衡量从研究开始或治疗开始到患者死亡的总时间。
- RFS代表无复发生存期,衡量患者从治疗结束到肿瘤复发的时间。
- TBs代表肿瘤芽,与肿瘤侵袭和不良预后相关。
- TLSs代表三级淋巴结构,与免疫反应和可能的较好预后相关。
通过图3,研究人员能够评估TLS/TB指数作为预后生物标志物的潜力,并探索其在不同独立患者群体中的适用性。预期结果显示,具有较高TLS/TB指数的患者群体会有更长的OS和RFS,这可能有助于临床决策和患者管理。
五、AI病理改进当前对二期结直肠癌的风险分层,更好地评估复发风险并指导辅助化疗

一作&通讯
| 角色 | 姓名 | 单位名称(中文) |
|---|---|---|
| 第一作者 | Christina Wu | 梅奥诊所,凤凰城,亚利桑那州 |
| 第一作者(共同) | Reetesh K. Pai | 匹兹堡大学医学中心病理科,匹兹堡,宾夕法尼亚州 |
| 通讯作者 | Rish K. Pai | 梅奥诊所,斯科茨代尔,亚利桑那州 |
文献概述
这篇文章报道了一项研究,该研究通过整合数字病理生物标记物QuantCRC改进了二期错配修复功能正常结直肠癌的风险分层方案,以更精准地预测无复发生存期并指导临床治疗决策。
研究的目的是改进当前对二期结直肠癌(colorectal cancers, CRC)的风险分层,以便更好地评估复发风险并指导辅助化疗的使用。研究团队探索了将QuantCRC这一数字病理生物标记物与美国临床肿瘤学会(ASCO)当前指南相结合的风险分层方案。
研究设计包括将ASCO和QuantCRC整合方案应用于三个大型学术医疗中心的398例错配修复功能正常(mismatch-repair proficient, MMRP)的二期结直肠癌患者。QuantCRC方案利用了pT3与pT4分期以及QuantCRC衍生的风险分类来评估无复发生存期(recurrence-free survival, RFS)。
研究结果显示,与ASCO方案相比,整合QuantCRC的方案为二期MMRP结直肠癌提供了更好的风险分层。QuantCRC整合方案将更多的二期肿瘤归为低风险组,同时不影响3年RFS的优异表现。此外,QuantCRC整合方案在中等风险和高风险组中提供了更大的风险比(hazard ratio, HR),并且这些风险组在未接受任何辅助化疗的患者亚组中仍然具有预后意义。
研究还讨论了目前对二期结直肠癌的风险分层存在的问题,并指出需要改进以减少不必要的化疗带来的副作用和成本。研究强调了使用数字生物标记物QuantCRC的潜力,这是一种基于苏木精-伊红染色切片的分析方法,可以提供更准确的风险评估。
最后,文章讨论了QuantCRC整合方案的临床意义,并提出了未来研究方向,包括在更大规模的患者群体中验证这一风险分层方案,并探索将其与ctDNA等其他生物标记物结合使用的可能性。
基线数据
表1提供了参与该研究的二期错配修复功能正常(MMRP)结直肠癌患者的临床和病理参数的详细信息。

-
研究时间范围:不同医疗中心的研究时间范围有所不同,Mayo Clinic是2017-2020年,UPMC是2010-2015年,而Mount Sinai Hospital Toronto是2011-2016年。
-
性别和年龄:
- 女性占比约43.7%。
- 中位年龄为68岁,年龄数据的标准差(IQR)在不同中心略有不同,但整体集中在18岁左右。
-
肿瘤位置:
- 肿瘤位于近端结肠的占51.8%,远端结肠的占48.2%,不同中心之间存在统计学差异(P=0.03)。
-
肿瘤分级:
- 大多数肿瘤(96%)为低级别(Low grade),高级别(High grade)的肿瘤仅占4%,不同中心之间存在统计学差异(P=0.006)。
-
pT分期:
- pT3期肿瘤占84.7%,pT4期肿瘤占15.3%,其中包括pT4a期占11.3%,pT4b期占4.0%,不同中心之间存在统计学差异(P=0.04)。
-
静脉、淋巴、或神经周围侵犯(VELIPI):
- 没有VELIPI的肿瘤占60.1%,有VELIPI的肿瘤占39.9%,不同中心之间存在显著统计学差异(P<0.001)。
-
肿瘤芽分级(Tumor budding grade):
- Bd1分级占64.8%,Bd2分级占20.4%,Bd3分级占14.8%,不同中心之间存在显著统计学差异(P<0.001)。
-
肠梗阻(Bowel obstruction):
- 没有肠梗阻的肿瘤占88.7%,有肠梗阻的占11.3%,不同中心之间存在显著统计学差异(P<0.001)。
-
术前癌胚抗原(CEA)水平:
- 未升高的占51.0%,升高的占24.1%,未检测的占24.9%,不同中心之间存在统计学差异(P=0.08)。
-
辅助化疗:
- 未接受辅助化疗的患者占81.7%,接受辅助化疗的占15.9%,其中接受FOLFOX、CAPOX、5-FU/capecitabine方案的患者比例不同,不同中心之间存在统计学差异(P<0.001)。
表中还包括了不同中心的P值,用以评估各参数在不同中心间的差异是否具有统计学意义。整体来看,研究队列在不同中心之间存在一些临床和病理特征的差异,这可能对风险分层和治疗决策有重要影响。
图表分析
图1
Figure 1 展示了二期错配修复功能正常(MMRP)结直肠癌的无复发生存期(RFS)与病理特征及QuantCRC特征之间的关系,使用Kaplan-Meier分析法进行展示。

A. pT分期:此图展示了不同pT分期(pT3和pT4)的肿瘤患者RFS的比较。通常,pT4期肿瘤比pT3期肿瘤有更高的复发风险。
B. 病理学家判定的肿瘤芽分级:此图展示了根据肿瘤芽分级(Bd1, Bd2, Bd3)的RFS差异。高级别的肿瘤芽(Bd2和Bd3)通常与较低的RFS相关。

C. 静脉、淋巴或神经周围侵犯(VELIPI):此图展示了有无VELIPI特征的肿瘤患者RFS的比较。VELIPI通常被认为是一个不良的预后因素。
D. QuantCRC %TB/PDC:此图展示了QuantCRC分析中,肿瘤芽/未分化肿瘤簇(TB/PDC)所占百分比对RFS的影响。高水平的TB/PDC可能与较低的RFS相关。

E. QuantCRC %不成熟基质(肿瘤床):此图展示了QuantCRC分析中,肿瘤床内不成熟基质所占百分比对RFS的影响。高水平的不成熟基质可能与较低的RFS相关。
F. QuantCRC 肿瘤:基质比例:此图展示了QuantCRC分析中,肿瘤与基质比例对RFS的影响。肿瘤与基质的比例可能与肿瘤的侵袭性和RFS有关。
表2
表2展示了一期临床II期错配修复功能正常(MMRP)结直肠癌患者无复发生存期(RFS)的单变量Cox比例风险模型分析结果。

-
病理变量:
- pT分期:pT3期作为参照组(ref),pT4期的肿瘤与RFS的相关性HR值为1.72,但统计上不显著(P=0.08)。
- 肿瘤分级:低级别肿瘤作为参照组,高级别肿瘤的HR值为0.05,这表明高级别肿瘤的RFS风险极低,但统计上不显著(P=0.27)。
- VELIPI(静脉、淋巴或神经周围侵犯):存在VELIPI的肿瘤相比没有VELIPI的肿瘤有更高的复发风险(HR=1.48),但统计上不显著(P=0.13)。
- 肿瘤芽分级:与低级别肿瘤芽(Bd1)相比,中级(Bd2)和高级别(Bd3)肿瘤芽的HR值分别为2.19和2.60,表明它们与更短的RFS显著相关(P=0.01和P=0.003)。
- 肠梗阻:存在肠梗阻的肿瘤与没有肠梗阻的肿瘤相比,其HR值为1.65,但统计上不显著(P=0.20)。
-
QuantCRC变量:
- %肿瘤:高百分比肿瘤与低百分比肿瘤相比,与改善的RFS显著相关(HR=0.33,P=0.001)。
- %基质:高百分比基质与低百分比基质相比,与降低的RFS显著相关(HR=3.04,P=0.002)。
- 肿瘤:基质比:高肿瘤:基质比与低肿瘤:基质比相比,与改善的RFS显著相关(HR=0.30,P=0.001)。
- %TB/PDC(肿瘤芽/未分化肿瘤簇):高百分比TB/PDC与低百分比TB/PDC相比,与降低的RFS显著相关(HR=3.12,P=0.0009)。
- %不成熟基质(肿瘤床):高百分比不成熟基质与低百分比不成熟基质相比,与显著降低的RFS相关(HR=3.88,P=0.0002)。
- %炎症基质(基质区域):高百分比炎症基质与低百分比炎症基质相比,与改善的RFS显著相关(HR=0.47,P=0.02)。
Cox比例风险模型是一种常用的统计方法,用于评估多个因素对生存时间的影响。表中的HR(风险比)值表示每增加一个单位的协变量,风险增加的倍数。P值用于评估每个变量与RFS之间的关联是否具有统计学意义,通常P<0.05被认为是统计显著的。这些结果有助于识别与RFS相关的病理特征和QuantCRC定量特征,为临床决策提供依据。
图2
Figure 2 包含了六个部分,分别描述了两种风险分层方案(ASCO和QuantCRC整合方案)的流程图以及它们在预测二期错配修复功能正常(MMRP)结直肠癌患者无复发生存期(RFS)方面的有效性。

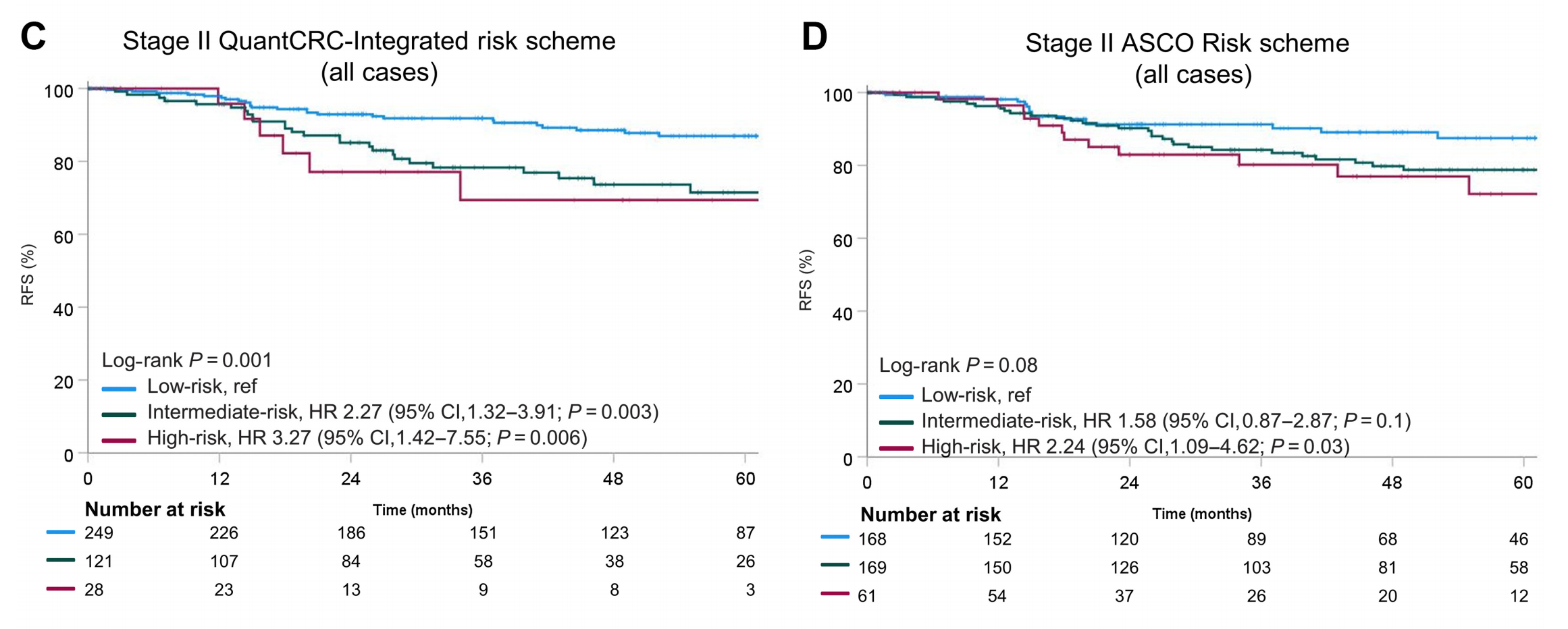

A. QuantCRC整合风险方案流程图:
- 这部分展示了如何根据QuantCRC标准将患者分为低风险(蓝色)、中等风险(绿色)和高风险(红色)组。
B. ASCO风险方案流程图:
- 类似于A部分,这部分展示了根据ASCO指南将患者分为低、中、高风险组的流程。
C. QuantCRC方案下的RFS,不考虑辅助化疗(ACT):
- 此图展示了按照QuantCRC方案分层的患者,不考虑是否接受ACT,其RFS的Kaplan-Meier生存曲线。预期是低风险组的RFS最好,高风险组的RFS最差。
D. ASCO方案下的RFS,不考虑ACT:
- 与C部分相似,此图展示了按照ASCO方案分层的患者RFS的生存曲线。可以比较两种方案在不考虑ACT情况下的RFS差异。
E. 未接受ACT的QuantCRC方案下的RFS:
- 这部分专注于那些没有接受ACT的患者,并根据QuantCRC方案分层展示他们的RFS。这有助于评估QuantCRC方案在实际临床情况(未接受ACT)中的有效性。
F. 未接受ACT的ASCO方案下的RFS:
- 与E部分相似,此图专注于未接受ACT的患者,并根据ASCO方案分层展示他们的RFS,可以评估ASCO方案在未接受ACT患者中的有效性。
表3
表3提供了根据ASCO风险方案和QuantCRC整合风险方案对二期MMRP结直肠癌患者预估的3年无复发生存期(RFS)的数据,并且根据是否接受辅助化疗(ACT)进行了分组。
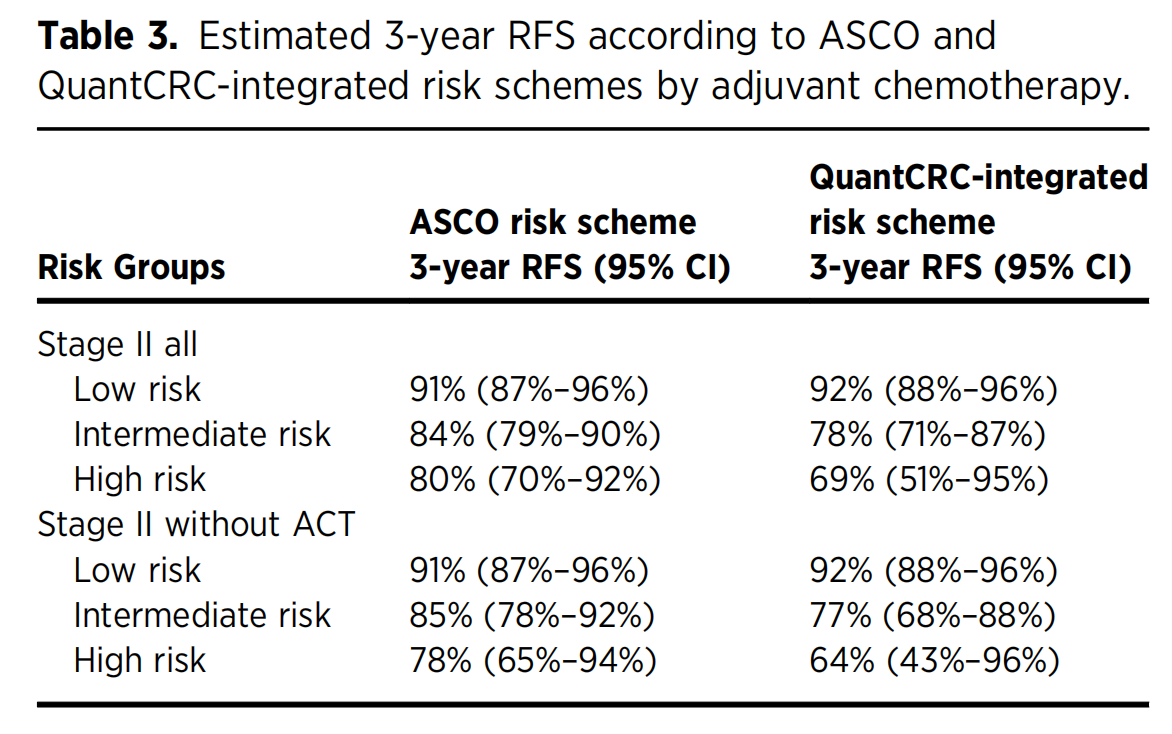
-
总体3年RFS估计:
- 在所有二期患者中,ASCO方案的低风险组预估3年RFS为91%,QuantCRC整合方案的低风险组为92%,两者相近。
- ASCO方案的中等风险组预估3年RFS为84%,而QuantCRC整合方案为78%。
- ASCO方案的高风险组预估3年RFS为80%,QuantCRC整合方案为69%。
-
未接受ACT患者的3年RFS估计:
- 未接受ACT的低风险组中,ASCO方案的预估3年RFS为91%,QuantCRC整合方案为92%,同样相近。
- 未接受ACT的中等风险组中,ASCO方案的预估3年RFS为85%,QuantCRC整合方案为77%。
- 未接受ACT的高风险组中,ASCO方案的预估3年RFS为78%,QuantCRC整合方案为64%。
-
风险分层的比较:
- 在所有接受评估的患者中,QuantCRC整合方案相比ASCO方案,在中等风险和高风险组中预估的3年RFS较低,这表明QuantCRC整合方案可能更严格地识别出复发风险较高的患者群体。
- 在未接受ACT的患者中,QuantCRC整合方案的中等风险和高风险组预估3年RFS同样低于ASCO方案,这可能表明QuantCRC整合方案在没有化疗影响的情况下,也能更准确地预测患者的预后。
-
临床意义:
- 这些数据表明QuantCRC整合风险方案可能有助于更精确地识别那些真正需要辅助化疗的高风险患者,同时减少对低风险患者不必要的治疗。
- 预估的3年RFS较高,即使在QuantCRC整合方案中更多的患者被归类为低风险组,也显示出良好的预后,这可能有助于减少对这些患者的过度治疗。
-
限制和考量:
- 表中的数据需要结合实际的临床实践和患者的具体情况来解读。
- 虽然QuantCRC整合方案在某些情况下提供了更低的预估3年RFS,但是否这将转化为临床上显著的差异,需要进一步的临床试验和长期随访来验证。




)


DDR、MSI电机、SV510、SV520、SV660软件简单调试)

)


)






