今天给同学们分享一篇实验文章“Pharmacotypes across the genomic landscape of pediatric acute lymphoblastic leukemia and impact on treatment response,这篇文章发表在Nat Med期刊上,影响因子为82.9。

结果解读:
与ALL药物敏感性的临床特征相关联
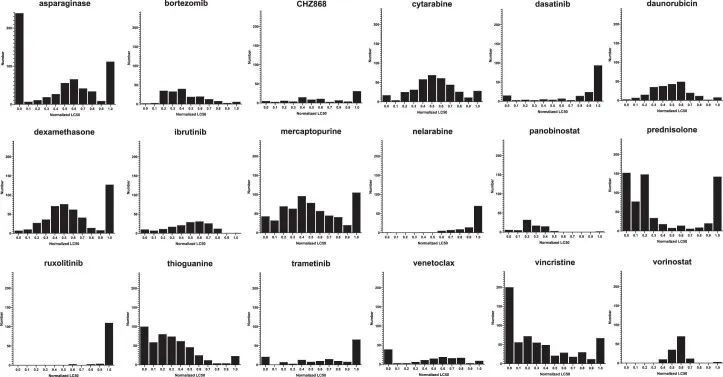
对805名患者的白血病细胞进行了18种药物的敏感性测量(图1和表1),共计5,447个50%致死浓度(LC50)测量值(附表1和附表2)。同时,作者对诊断性急性淋巴细胞白血病细胞进行了RNA测序(RNA-seq),将每个患者分为23个独特的亚型之一。在所有药物中,作者观察到药物敏感性存在广泛的个体间变异,平均变异系数为55.3%(范围为8.7-105.4%;扩展数据图1)。
药物敏感性在所有亚型之间有所不同
作者接下来试图表征在ALL的体细胞基因组景观中的药物敏感性。18种药物中有14种显示出亚型间变异的显著性(P < 0.05),例外是泛泡利诺斯他、鲁索利替尼、硼替佐米和多柔比星(图2a,扩展数据图2和补充表4)。
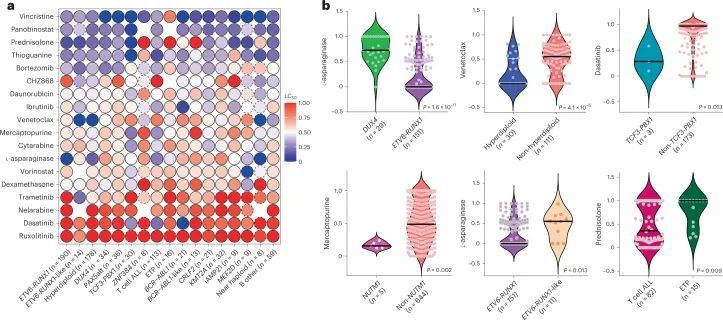
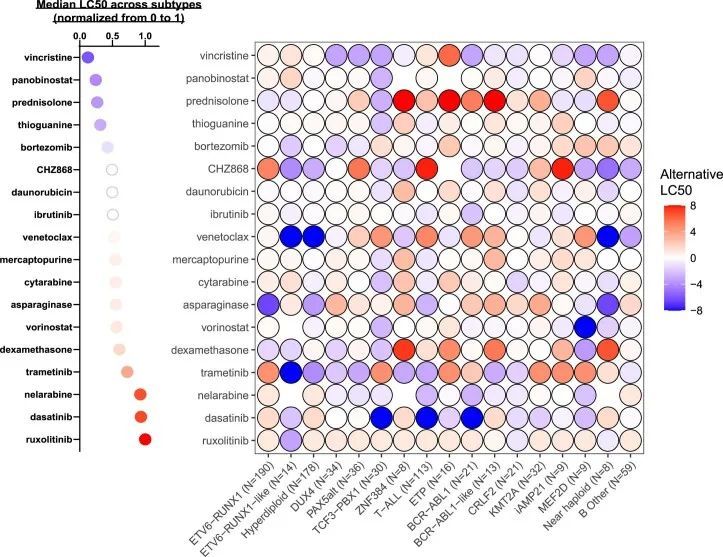
ETV6-RUNX1和高倍体ALL对常用的四种诱导缓解药物(PVDL)非常敏感,重现了这些亚型对化疗的响应性。对于这两种已知有良好预后的亚型,ETV6-RUNX1的PVDL LC中位数为0.18,高倍体为0.26,均显著低于其余亚型的0.41(分别为P < 0.001和P = 0.004)。相比之下,已知预后较差的亚型BCR-ABL1、BCR-ABL1-like和KMT2A的PVDL LC较高(分别为0.46,P = 0.001;0.66,P < 0.001;0.54,P < 0.001,与ETV6-RUNX1相比)。最近发现的预后良好亚型DUX4的PVDL LC为0.33(与ETV6-RUNX1相比,P < 0.001),其L-天冬氨酸酶LC显著较高(0.73与ETV6-RUNX1的0相比,P < 0.001;图2b),与其已知的早期缓解诱导期间仅使用这四种药物的慢速MRD清除一致。
作者还观察到高度亚型依赖的靶向药物敏感性模式。与非高倍体相比,高倍体对维奈替克索的敏感性显著增加(P < 0.001)(图2b)。T细胞急性淋巴细胞白血病(与非T细胞急性淋巴细胞白血病相比,LC 50 0.20,P < 0.001)、TCF3-PBX1(与非TCF3-PBX1相比,LC 50 0.28,P = 0.013;图2b)和BCR-ABL1(与非BCR-ABL1相比,LC 50 0,P < 0.001)对达沙替尼的敏感性也较高,这与作者和其他人的先前研究结果一致 35,36 。BCR-ABL1对依布替尼也敏感(与非BCR-ABL1相比,LC 50 0.09,P = 0.002;扩展数据图3a)。NUTM1对多种抗代谢药物的LC 50 较低:阿糖胞苷的LC 50 0.09(P = 0.007,与非NUTM1亚型相比)、巯基嘌呤的LC 50 0.16(P = 0.002;图2b)和硫鸟嘌呤的LC 50 0(P = 0.0003)。
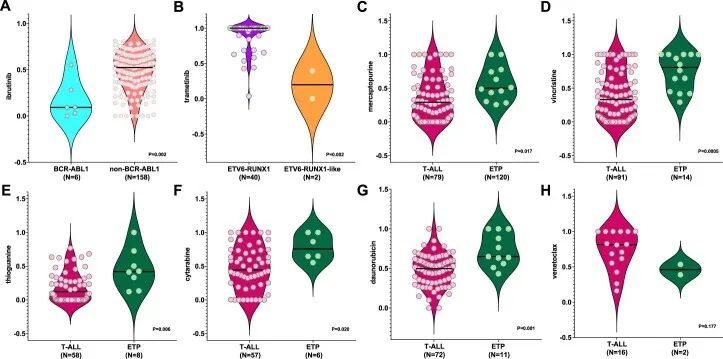
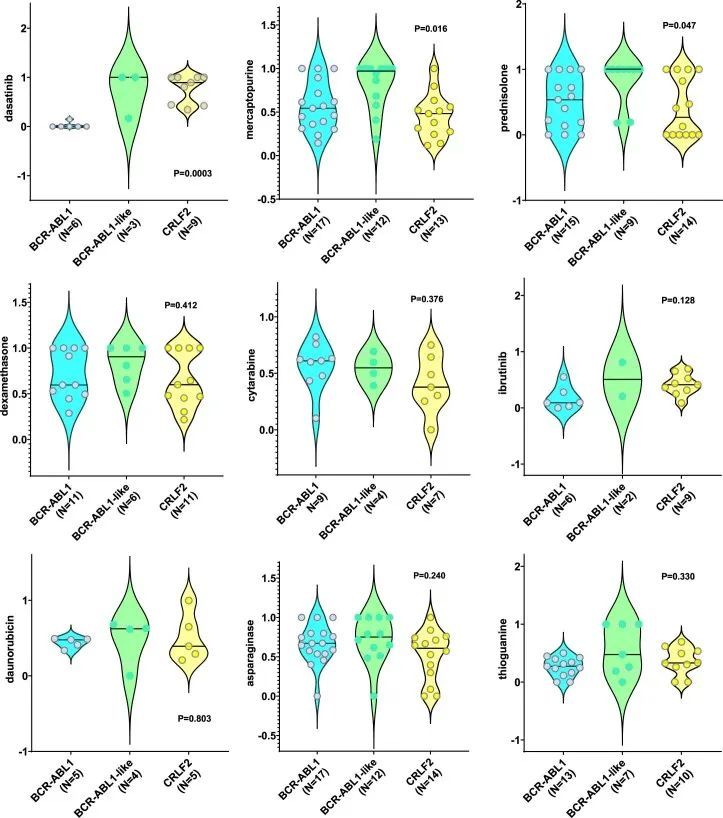
尽管ETV6-RUNX1样和ETV6-RUNX1 ALL在全球基因表达谱方面几乎相同,但在药物敏感性方面存在显著差异:与ETV6-RUNX1相比,ETV6-RUNX1样ALL对L-天冬氨酸酶(LC 50 0.55比0,P = 0.013)更具抗药性;但对曲美替尼的敏感性增加(LC 50 0.20对比1.0,P = 0.002)。BCR-ABL1、BCR-ABL1样和CRLF2基于全局转录谱和体细胞基因组特征也相互关联,然而这三个亚型对达沙替尼(LC 50 0对比1.0对比0.89,P < 0.001)、巯基嘌呤(LC 50 0.54对比0.97对比0.48,P = 0.016)和泼尼松(LC 50 0.54对比1.0对比0.27,P = 0.047)的敏感性有所不同,但对其他细胞毒性和靶向药物的反应相似(扩展数据图 Fig.4)。与其他T细胞ALL相比(扩展数据图3c-h),早期T细胞前体(ETP)ALL对抗代谢物和非抗代谢物细胞毒性药物更具抗药性:长春新碱(LC 50 0.81对比0.33,P < 0.001)、泼尼松(LC 50 1.0对比0.36,P = 0.009;图 Fig.2b),2b),硫嘌呤(巯基嘌呤LC 50 0.50对0.29;P = 0.017和巯基鸟嘌呤LC 50 0.42对0.12;P = 0.006),阿糖胞苷(LC 50 0.76对0.45,P = 0.023)和多柔比星(LC 50 0.65对0.50,P = 0.001)。ETP显示出与T细胞急性淋巴细胞白血病相比更高的维奈托克拉克敏感性的趋势,尽管在这个相对较小的队列中这种趋势在统计学上并不显著(LC 50 0.46对0.81)。综上所述,作者的数据指出了急性淋巴细胞白血病中新的亚型特异性治疗机会。为了探索多重检验的影响,作者还对这些亚型相关比较进行了Benjamini-Hochberg校正(附表5),大多数关联仍然显著。
所有体外药物敏感性与MRD的关联
作者评估了药物LC与体内反应的关联性,反映在缓解诱导治疗期间的MRD上。对于每个患者,MRD在第15天和第42天进行测量。在本研究中,作者评估了每种药物的线性回归系数(β),其中每个系数的单位变化表示MRD的单位变化(对数转换),即0.30的系数(或log(2))表示抵抗患者的MRD是敏感患者的两倍;-0.30的系数(或log(0.5))表示MRD是一半。系数为零表示抵抗患者和敏感患者之间的MRD没有差异。
与MRD显著相关的药物在B细胞ALL和T细胞ALL之间存在明显差异(图3a,b)。在B细胞ALL中,与第15天和第42天的MRD呈正相关的药物包括L-天冬氨酸酶(β = 0.30;P < 0.001,第15天;β = 0.23;P < 0.001,第42天)、泼尼松龙(β = 0.30;P < 0.001,第15天;β = 0.25;P < 0.001,第42天)、地塞米松(β = 0.28;P < 0.001,第15天;β = 0.17;P < 0.001,第42天)和巯基嘌呤(β = 0.17;P < 0.001,第15天;β = 0.17;P < 0.001,第42天)。此外,硫唑嘌呤(β = 0.18;P < 0.001)和阿糖胞苷(β = 0.15;P = 0.009)也与第15天的MRD相关。对于T细胞ALL,帕诺比尼斯塔(β = 0.56;P = 0.028)和达沙替尼(β = 0.42;P = 0.034)与第15天的MRD呈正相关,而维内替克拉显负相关(β = -0.50;P = 0.039)。奈拉替尼与第42天的MRD呈正相关(β = 0.57;P = 0.025)。
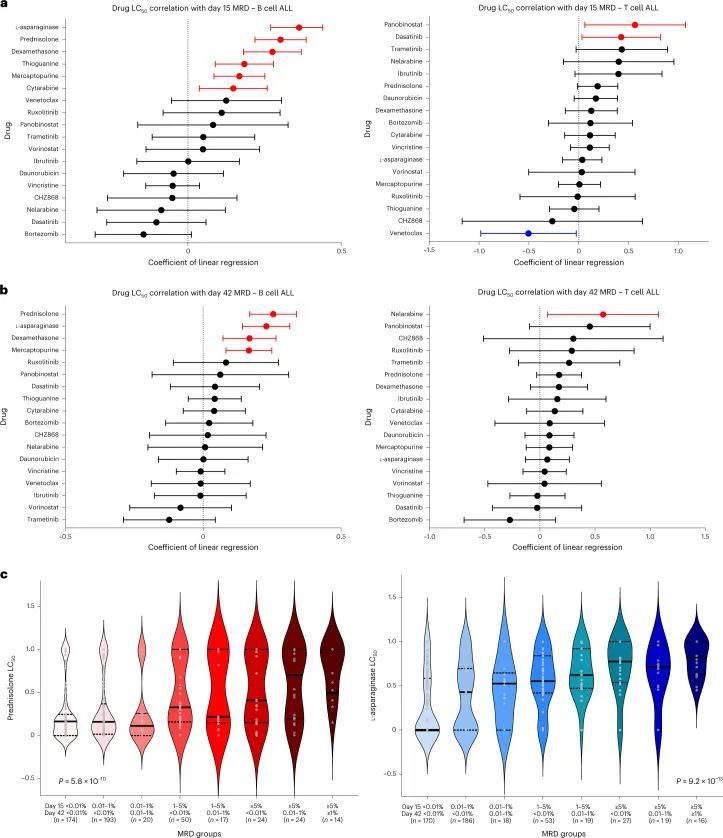
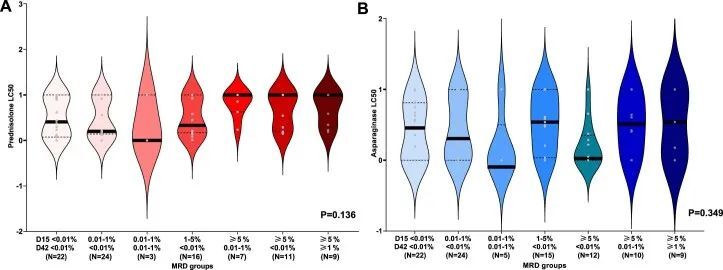
利用纵向MRD数据(第15天和第42天),作者还将患者分为诱导治疗抵抗力增加的组,即早期清除白血病并保持MRD阴性的患者最为敏感,而两个时间点均具有高MRD的患者最为抵抗。在B细胞ALL中,泼尼松和L-天冬氨酸酶LC 50 随着MRD类别的上升而逐渐增加(两者的P值均小于0.001;图3c),但在T细胞ALL中则不然(泼尼松的P值为0.136,L-天冬氨酸酶的P值为0.349;扩展数据图5),表明药物抵抗对MRD的影响具有特定于谱系的效应。更重要的是,白血病细胞对泼尼松的抵抗在体外最能预测MRD的持续性(即第42天的MRD阳性)。相反,白血病细胞对L-天冬氨酸酶的敏感性与早期MRD清除(即第15天的MRD阴性)最为显著相关。
药物类型定义了不同的急性淋巴细胞白血病亚型和预后
为了解决药物敏感性测量中的缺失问题,作者使用顺序回归多重插补(n = 10)来填补LC 50 值。将无监督的层次聚类分析应用于一个8,050 × 18数据点的矩阵,作者观察到6个ALL病例的聚类,具有独特的药物反应表型模式(图4)。
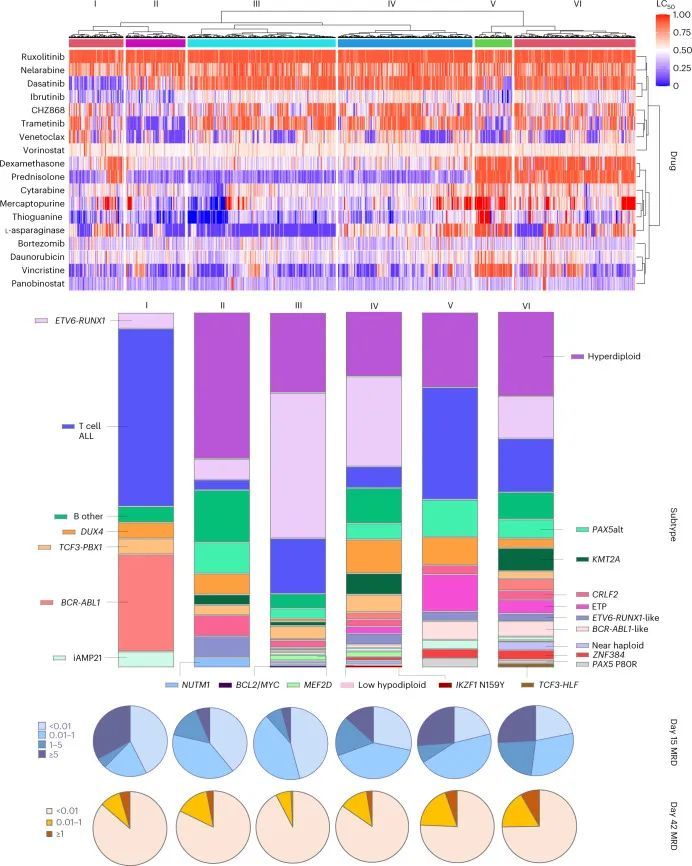
集群I的定义是对达沙替尼和伊布替尼敏感,而集群II对维内替克和曲美替尼敏感。集群III中的病例普遍对L-天冬氨酸酶和泼尼松敏感。集群IV对泼尼松的敏感性与集群III相似,但在L-天冬氨酸酶抵抗方面有所不同。集群V是最抵抗的群体,在所有细胞毒性药物(类固醇、L-天冬氨酸酶、长春新碱、多柔比星和硫嘌呤类药物)中具有最高的LC 50 。然而,该群体对曲美替尼、维内替克和伊布替尼等靶向药物也表现出一定的敏感性。集群VI的药物敏感性特征更加多样,对糖皮质激素具有一致的抵抗性,但对其他细胞毒性或靶向药物的反应不一。
总体而言,每个基于药物敏感性的聚类中都存在高度的体细胞基因组异质性(P < 0.001)。聚类I主要由对达沙替尼敏感的亚型组成,即BCR-ABL1(27%)和T细胞急性淋巴细胞白血病(50%)。聚类II中高度比例为超二倍体(41%)。聚类III中ETV6-RUNX1的比例最高(41%),其次是超二倍体急性淋巴细胞白血病(23%),可能由对化疗敏感的低风险急性淋巴细胞白血病组成。聚类IV非常异质,代表了19种不同的亚型。在这个聚类中,DUX4(9%)和KMT2A(6%)的比例较高。聚类V中有更高比例的T细胞急性淋巴细胞白血病(31.6%),ETP ALL(10.5%)和BCR-ABL1样(5.3%)。聚类VI的亚型组成也非常多样,高度流行的是KMT2A(6.5%)和BCR-ABL1样(4.3%),而TCF3-HLF仅出现在这个聚类中,所有这些都与不良预后相关。
MRD反应在药物敏感性亚型群中也存在显著差异(P < 0.001,分别对应第15天和第42天的MRD)。亚型群I、II和III代表了早期白血病迅速清除的患者(分别为第15天MRD阴性的比例为43%、39%和46%),相比之下,亚型群IV、V和VI的比例较低(分别为28%、21%和22%),尽管亚型群I中也有相当大比例的难治性患者(MRD第15天≥5%的比例为33%)。到了第42天,亚型群I、II和III仍然表现出较高的MRD阴性率(分别为86%、82%和93%)。亚型群IV患者在第15天MRD阳性率较高,但在随后的诱导治疗中,MRD清除率明显提高,到了第42天MRD阴性比例为85%,这是作者之前对DUX4亚型报道过的典型反应。相比之下,亚型群V和VI表现出持续的不良反应,有更高比例的病例在第42天显示MRD阳性。
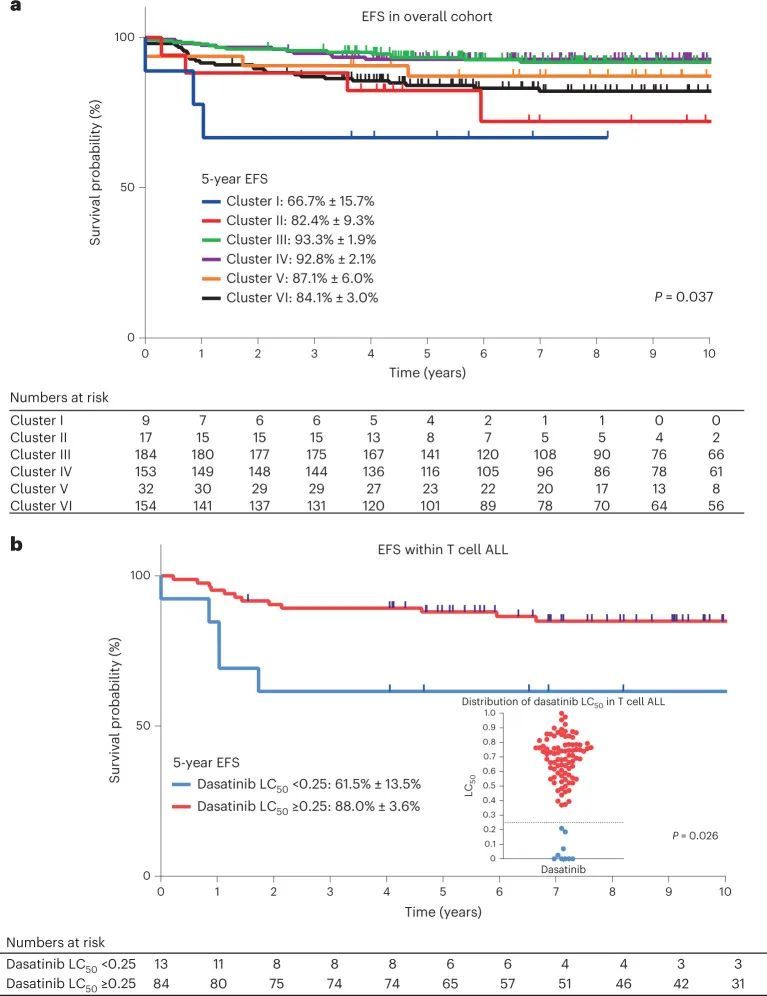
最后,作者评估了药物敏感性聚类模式与ALL治疗结果的关联,重点关注了Total Therapy XV和XVI试验,这些试验的长期生存数据已经成熟。除了患者中白细胞计数<50×10^9/L的比例较高外,本分析中包含和排除的患者在临床特征上没有差异(附表6)。事件无病生存(EFS)在6个药物敏感性聚类中显著不同(P = 0.037;图5a),即使在调整了第42天MRD后,药物敏感性聚类仍然具有预后价值(附表7)。以类固醇和噻嗪核苷敏感性为特征的III和IV类聚类具有最好的生存结果,与MRD迅速清除相一致。相比之下,以达沙替尼敏感性为主要特征的I类聚类在这个队列中的结果最差。事实上,这一组中的三个事件都发生在达沙替尼敏感性的T细胞ALL病例中,而BCR-ABL1 ALL病例中没有发生。因此,作者评估了97名T细胞急性淋巴细胞白血病患者中达沙替尼敏感性的预后意义,其中没有接受达沙替尼治疗的患者。作者发现较高的达沙替尼敏感性(LC 50 < 0.25)与较差的事件自由生存期(风险比= 3.3,95%置信区间(CI)= 1.3-10.8,P = 0.026;图 Fig.5b)相关。达沙替尼敏感性在T细胞急性淋巴细胞白血病中的预后影响大于MRD,并在调整MRD后仍然显著(附表8)。
总结
总之,作者全面地描述了儿童急性淋巴细胞白血病(ALL)中不同分子亚型的药物反应特征,评估了药物敏感性与患者早期治疗反应的关联,并探索了基于药物分型的ALL亚群分组及其对生存结果的影响。作者的研究结果具有潜在的临床意义,因为它们为设计新的联合治疗方案提供了新的见解,特别是与ALL分子亚型相结合。通过这些方法,未来的治疗可以个体化,进一步改善每个儿童ALL的预后。对这篇文章的思路感兴趣的老师,欢迎咨询!
——list模拟实现扩展)



第228题汇总区间(Python))











函数、结构体、共用体、枚举 2月1日学习笔记)


