
“十字交叉法”是高中化学计算题中巧解二元混合物问题的一种常用的有效方法,正确运用“十字交叉法”,可以帮助同学们方便、迅速地解决计算问题。
速解的前提:1、必须清楚“十字交叉法”运用后的比例比系——“看分母”法则。即特性数值的分母所表示的物理量之比。因为对于二元混合物而言,设x1、x2是混合物两组分的某化学量,α1、α2 为两组分的特性数值,ā为混合物的特性数值,若满足方程式α1 x1 +α2 x2 == ā(x1 + x2)
可知 x1(α1-ā) == x2(ā-α2) 即 x1/x2 ==(ā-α2)/(α1-ā)。
凡满足上述方程式的化学量的求解都不得可以用特性数值的“十字交叉法”形式来表示:
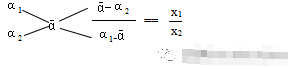
2、必须清楚“十字交叉法”的适用范围
| α1、α2 | ā | x1、x2 |
| |
1 | 相对分子质量 | 平均相对分子质量 | 物质的量、体积分数 | 物质的量比、 体积比 | |
2 | 同位素 相对分子质量 | 元素平均相对原子质量 | 同位素原子百分组成 | 原子个数比 物质的量比 | |
3 | 密度 | 混合密度 | 体积分数 | 体积比 | |
4 | 质量分数 | 混合溶液的质量分数 | 质量分数 | 质量比 | |
5 | 物质的量浓度 | 混合液物质的量浓度 | 体积分数 | 体积比 | |
6 | 燃烧热 | 平均热量 | 体积、物质的量分数 | 气体体积比 | |
7 | 分子组成 | 平均组成 | 体积、物质的量分数 | 气体体积比 | |
8 | 消耗量 | 平均消耗量 | 体积、物质的量分数 | 气体体积比 | |
9 | 用于某些综合计算 | ||||
现举几例,若按常规方法解二元一次方程,虽好理解,但费时且麻烦,若能正确运用“十字交叉法”,便可方便、迅速、准确地解题。
例1 现有100克碳酸锂和碳酸钡的混和物,它们和一定浓度的盐酸反应时所消耗盐酸跟100克碳酸钙和该浓度盐酸反应时消耗盐酸量相同。计算混和物中碳酸锂和碳酸钡的物质的量之比。
分析可将碳酸钙的式量理解为碳酸锂和碳酸钡的混和物的平均式量,利用十字交叉法计算可有:

所以,碳酸锂和碳酸钡的物质的量之比为97∶26。
例2 天然的和绝大部分人工制造的晶体都存在各种缺陷。例如在某种NiO晶体中就存在如右图所示的缺陷:1Ni2+个空缺,另有2个Ni3+取代,其结果晶体仍呈电中性,但化合物中Ni原子和O原子的比值却发生了变化。该氧化镍样品组成为Ni0.97O,试计算该晶体中的Ni3+和Ni2+的离子个数比。
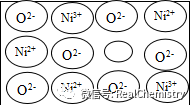
分析 本题所求的是Ni3+和Ni2+的离子个数比,所以我们所选的特性数值的分母必须是Ni3+和Ni2+的离子个数。由此可知:
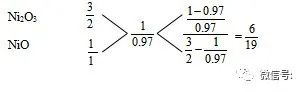
所以,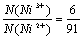
例3 某亚硫酸钠已部分被氧化成硫酸钠,经测定混合物中的质量分数为25%,求该混合物中亚硫酸钠与硫酸钠的物质的量之比。
分析 本题目传统解法是解二元一次方程,但需要假设一些数据,比较费时,但如正确运用“十字交叉法”,弄清比例关系,则能很快地解决问题

根据前面介绍的“看分母”法则可知计算出的比例是亚硫酸亚铁钠与硫酸钠中所含硫元素的质量比,但因是同种元素,且每个分子中均含1个硫原子,所以硫的质量比即等于其物质的量之比,所以二者物质的量之比为7∶1。
例4 配平S + Ca(OH)2 — CaS2O3 + CaS5 + H2O
分析在该反应中S元素发生歧化反应,而CaS5中S的价态不好确定,假定S5的价态为-2价,Ca元素为+2价。
第一步写出S元素的三种不同价态: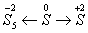 ;
;
第二步根据十字交叉法找出各种价态的原子个数:

可看出在化学方程式中CaS2O3 、CaS5的系数分别为1、2。其它物的系数用观察法配平,系数依次是12、3、1、2、3。
若要用十字交叉法来求物质的量的关系,须假设两纯量和中量为等物质的量(对于气体也可以设等体积),找出对应的质量(若设1 mol,则为各物质的摩尔质量,数值就是相对分子质量),画质量关系的十字交叉图示求解;若要用十字交叉法来求质量的关系,则须假设两纯量和中量为等质量,找出对应的物质的量(对于气体也可以是体积),然后画物质的量(或体积)十字交叉图示求解。
1.已知平均分子式中角标的十字交叉法
常温常压下将2LCH4和C2H4的混合气体点燃充分燃烧后,恢复至起始状态,得到2.8L的气体,和一定质量的水(假定CO2不溶于水),求原混合气体中CH4和C2H4体积比。
解:由题可知,1mol混合气体中含1.4molC原子,设其平均化学式为C1.4Hy,由平均C原子数得
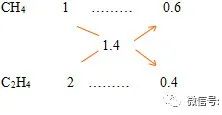
V(CH4):V(C2H4)=0.6:0.4=3:2
在标准状况下氢气和一氧化碳的混合气体7L,质量为2.25g,求H2和CO的体积分数?
解:标况下7L就是0.3125mol
那么混合气体的平均相对分子质量是2.25/0.3125=7.2
利用十字交叉法

所以H2和CO的物质的量之比是20.8比5.2即4比1
物质的量之比就是体积之比
2.已知同位素的相对原子质量求核素“丰度”的十字交叉法
估算铜有两种天然同位素63Cu和65Cu,铜的相对原子质量是63.5,63Cu的百分含量约为( )
A20% B25% C50% D75%
解:用十字交叉法可求得两种同位素的原子个数比

即63Cu与65Cu的原子个数比为3:1,所以63Cu %=75%,故应选D
3.已知混合气体的相对密度的十字交叉法
甲烷和丙烷混合气的密度与同温同压下乙烷的相同,混合气体中甲烷和丙烷的体积比是( )
A2:1 B3:1 C1:3 D1:1
解:甲烷和丙烷混合气体的密度与同温同压下的乙烷的密度相同,即甲烷和丙烷混合气体的的平均分子量与乙烷的分子量相等,即为30。
用十字交叉法
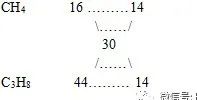
所以CH4:C3H8=1:1,故选D
4.已知混合物质量的十字交叉法
Li2CO3和BaCO3的混合物与盐酸完全反应,所消耗的盐酸的量与等质量的的CaCO3和同浓度盐酸反应所消耗的盐酸的量相等,则混合粉末中Li2CO3和BaCO3的质量比为( )
A3:5 B5:3 C7:5 D5:7
解: 首先请判断用下列十字交叉法求出两者之比是什么量之比.
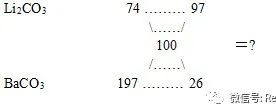
若设均与2 mol HCl反应,则所需的Li2CO3、BaCO3、CaCO3各1 mol,摩尔质量分别为74g/mol、197g/mol、100g/mol.故上面用十字交叉法求出的是Li2CO3和BaCO3的物质的量之比.然后换算为质量比.
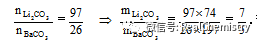
答案选C
5.已知混合物质量分数的十字交叉法
某温度下22%的硝酸钠溶液150mL,加水100g稀释后浓度变为14%,原溶液的物质的量浓度。
某Na2SO3已部分氧化成Na2SO4,经测定该混合物中硫的质量分数为25%,求混合物中Na2SO3和Na2SO4的物质的量之比 (整数比)?
解:设原溶液的质量为X,由十字交叉法得:
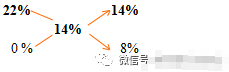
X/100g=14/8,X=175g,c=(175*22)/(85*0.15)=3.0mol/L,故原溶液的物质量浓度为3.0 mol/L
6. 已知同位素的相对原子质量求原子个数比的十字交叉法
知自然界中铱有两种质量数分别为191和193的同位素,而铱的平均原子量为192.22,这两种同位素的原子个数比应为 [ ]
A.39∶61B.61∶39 C.1∶1D.39∶11
解:铱元素的相对原子质量192.22是质量数分别为191和193的核素的平均值,可以采用十字交叉法:
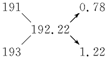
则两种同位素原子的个数比为0.78:1.22=39:61,故选A。
7.已知平均化合价的十字交叉法
今有铁的溴化物5.12g,其溶液与足量的AgNO3溶液完全反应,生成9.4gAgBr沉淀,则原混合物中FeBr2和FeBr3的物质量之比为( )
A1:1 B1:3 C2:1 D无法确定
解:设铁的溴化物中铁的平均化合价为x,则混合物的平均组成化学式为FeBrx。
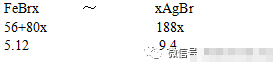
(56+80x):5.12=188x:9.4,解得x=2.5
用十字交叉
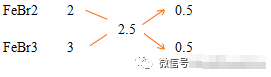
FeBr2和FeBr3的物质量之比为1:1
故选C。
8已知气体密度的十字交叉法
已知CH4, C2H4及其混合气体在同温同压下分别为 0.71 g / L 、1.25 g / L 、1.16 g / L.求混合气体CH4和C2H4的体积比是多少?
解:以1mol 混合气体密度1.16 g/L作为基准物 则十字交叉法如下:

求得CH4与C2H4 的体积比是 0.09:0.45=1:5
9.已知焓变的十字交叉法
已知 2H2(g)+O2(g)=2H2O(g) △H= —571.6kJ/mol
C3H8 (g)+5 O2(g)=3CO2(g)+4H2O(1) △H= —2220 kJ/mol
实验测得氢气和丙烷的混合气体共5 mol,完全燃烧时放热3847 kJ求H2和C3H8的体积比.
A.1:3 B.3:1 C.1:4 D.1:1
解: 是求出每摩 H2、C3H8完全燃烧时放出的热量,然后用十字交叉法求出.
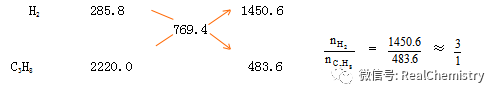
答案:B
10.已知单位物质生成物质质量的十字交叉
把0.200gNaCl和KI混和物溶于水后加入过量AgNO3溶液析出0.449 g, 求原混和物中NaCl和KI的质量百分数.
解:分别计算产生沉淀物的质量,根据化学方程式得:
0.200gNaCl生成0.490gAgCl
0.200gNaI生成0.283gAgI
则十字交叉法如下:

求得NaCl和KI的质量比是4/1,即他们的质量分数分别为80%、20%。
11.已知生成单位物质所需物质质量的十字交叉法
镁和铝的混合物10g,与足量的稀硫酸充分反应,生成1.0g氢气,求混合物中镁和铝的混合比为多少
解:在标准状况下,以混合物总质量10g作为基准物再根据镁铝与盐酸的关交叉式如下:
生成一克氢气所需镁12g,生成一克氢气所需铝9g,
混合金属生成一克氢气需10g(把混合物质看作新物质,定义平均量为其属性)
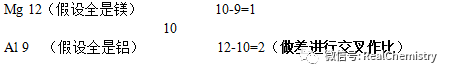
求得镁与铝的混合比例为1:2
12.十字交叉法的逆问题
将烷烃,烯烃按体积比5:1混合,混合气体体积是相同状况下等质量氢气的体积的1/16。则混合气体的组成为( )
A甲烷、乙烯 B乙烷、丙烯 C丁烷、丁烯 D甲烷、丁烯
解:混合气体的平均相对分子质量为Mr=16*2=32.设烷烃的分子式为CnH(2n+2),烯烃为CmH(2m),z则:
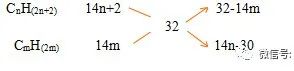
V(烷):V(烯)=(32-14m)/ (14n-30)=5/1,得
5n+m=13,由于m、n为正整数
所以m=3,n=2,即答案选B.
13三元混合体系十字交叉法
有一平均式量为30.4的CO、C2H4、O2的混合气体,经点燃完全反应后,气体中不再有CO、C2H4,求混合气体中氧气所占体积分数。
解:CO和C2H4的相对分子质量相等,可将CO、C2H4看做一组分,O2看做另一组分,由十字交叉法:
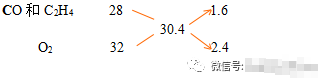
1.6/2.4=2/3,氧气所占体积分数为60%
有一平均相对分子质量为30.4的CO,C2H4,O2的混合气体,经点燃完全反应后,测得混合气体中不再有CO和C2H4,试通过计算填空:
(1)原混合气体中氧气所占的体积分数为?(参考答案:60%)
(2)原混合气体中CO的体积分数(用X表示)的取值范围为(用百分比表示)?(参考答案:24%=
(3)原混合气体中C2H4的体积分数(用Y表示)的取值范围为(用百分比表示)?(参考答案:0
参考解析
1)CO和C2H4相对分子质量相等,所以,可设1 mol混合气体中,O2为x mol,CO和C2H4即为(1-x) mol。
由题意可得32x+28(1-x)=30.4
x=0.6 mol
所以混合气体中O2占60%。
(2)设原混合气体体积为100 L,CO为x L,C2H4为(40-x)L。
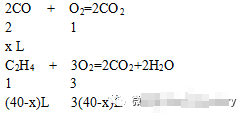
由题意可得:
+3(40-x)≤60
x≥24
所以,CO所占体积分数取值范围为:
24%≤x<40%。
14.过量反应混合物中十字交叉法
8molH2与6mol氧气充分反应,求生成水的质量
解:
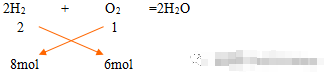
8*1mol<2*6mol,O2过量,生成水应以氢气为标准计算
M(H2O)=8mol*18g/mol=144g
 往期精彩
往期精彩又酸了!开学季最暖高校横幅来袭,学生:又是想好好学习的一天!
羡慕! 低分也能上好大学! 2020高招捡漏的16种途径
录取结果公布! 一本/二本/专科不仅是一纸学历之差!
已被大学录取但不去报到想复读,究竟会有啥影响?看完终于明白了!

▐ 声明:文章来源网络,版权归原作者所有,如有侵权联系小编立即删除!如有侵权,请联系删除。
▐ 标签:高考化学 精品干货
▐ 更多内容请关注微信公众号平台:高考化学ID:gkhx100

 戳原文,更有料
戳原文,更有料
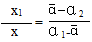
)








概念)









